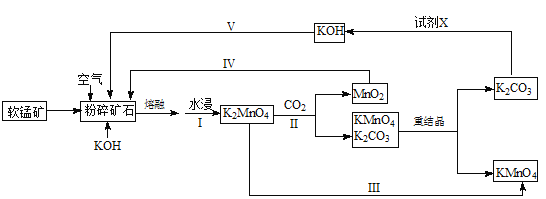
��Ŀ����
����Ŀ��X��Y��Z��Ϊ������Ԫ�أ�XԪ�ص���̬�⻯���ˮ��Һ������ɫ��̪��죬YԪ�ص������������Ǵ�����������2����ZԪ���Ƕ�����Ԫ����ԭ�Ӱ뾶����Ԫ�أ�He��Ne��Ar���⣩��
��1��д��X��Ԫ�ط��� ����ԭ�ӽṹʾ��ͼΪ ��
��2��Ԫ��Y������⻯��Ļ�ѧʽ ��
��3��ZԪ�ص�����������Ӧ��ˮ����ĵ���ʽΪ ��
��4��XԪ������������Ӧ��ˮ��������������Ӧ�����ӷ���ʽΪ ��
��5��YԪ�ص�����������ZԪ�صĹ��������������ԭ��Ӧ�Ļ�ѧ����ʽΪ ��
��6����2 L�ܱ������н������з�Ӧ��CO2��g����C��s��![]() 2CO��g�� ��H>0 �����ȣ��������������䣬ֻ�ı�����ijһ��Ӧ������������ѧ��Ӧ���ʵı仯���Ʋ�������ؼ��㡣
2CO��g�� ��H>0 �����ȣ��������������䣬ֻ�ı�����ijһ��Ӧ������������ѧ��Ӧ���ʵı仯���Ʋ�������ؼ��㡣
������C����ѧ��Ӧ���� ������������������С��������������
����С�ܱ��������������ѧ��Ӧ���� ������������������С��������������
������ʼʱ��2 mol CO��������������Ӧ��2S����CO2Ϊ0.6 mol����2S��CO��ƽ����Ӧ����Ϊ ��
���𰸡���1��N��![]() ��2��CH4��3��
��2��CH4��3��![]()
��4��Al2O3+6H+=2Al3++3H2O��5��2CO2+2Na2O2=2Na2CO3+O2
��6����������������0.3mol/��Ls��
�����������������X��Y��Z��Ϊ������Ԫ�أ�XԪ�ص���̬�⻯���ˮ��Һ������ɫ��̪��죬����̬�⻯��Ϊ����������XΪN��YԪ�ص������������Ǵ�����������2��������YΪC��ZԪ���Ƕ�����Ԫ����ԭ�Ӱ뾶����Ԫ�أ�He��Ne��Ar���⣩������ZΪNa���ʣ�1��X��Ԫ�ط��ź�ԭ�ӽṹʾ��ͼ�ֱ�ΪN ,ԭ�ӽṹ��![]() ��2��Ԫ��Y������⻯��Ļ�ѧʽΪCH4����3��ZԪ��ԭ�ӵ�������Ϊ11��ZԪ�ص�����������Ӧ��ˮ����ΪNaOH�������ʽΪ
��2��Ԫ��Y������⻯��Ļ�ѧʽΪCH4����3��ZԪ��ԭ�ӵ�������Ϊ11��ZԪ�ص�����������Ӧ��ˮ����ΪNaOH�������ʽΪ![]() ����4��XԪ������������Ӧ��ˮ��������������Ӧ�����ӷ���ʽΪ��Al2O3+ 6H+= 2Al3++ 3H2O;��5��YԪ�ص����������Ϊ������̼����ZԪ�صĹ�������Ϊ�������ƣ��������߷���������ԭ��Ӧ�Ļ�ѧ����ʽΪ2CO2+ 2Na2O2 = 2Na2CO3 + O2��6��CO2��g����C��s��=2CO��g�� ��H>0������CΪ�����壬�ı�������������ѧ��Ӧ���ʲ��䣻����С�ܱ�������������൱������ѹǿ�������˸����ʵ�Ũ�ȣ���ѧ��Ӧ��������������ʼʱ��2 mol CO��������������Ӧ��������CO2ΪX mol
����4��XԪ������������Ӧ��ˮ��������������Ӧ�����ӷ���ʽΪ��Al2O3+ 6H+= 2Al3++ 3H2O;��5��YԪ�ص����������Ϊ������̼����ZԪ�صĹ�������Ϊ�������ƣ��������߷���������ԭ��Ӧ�Ļ�ѧ����ʽΪ2CO2+ 2Na2O2 = 2Na2CO3 + O2��6��CO2��g����C��s��=2CO��g�� ��H>0������CΪ�����壬�ı�������������ѧ��Ӧ���ʲ��䣻����С�ܱ�������������൱������ѹǿ�������˸����ʵ�Ũ�ȣ���ѧ��Ӧ��������������ʼʱ��2 mol CO��������������Ӧ��������CO2ΪX mol
CO2��g����C��s��=2CO��g��
��ʼ 0 2 mol
�仯 X 2X
2S�� X 2-2X
X="0.6" mol V��C0��= ��2-2X��/2��2=��2-2��0.6��/4=0.3mol/��Ls��

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�