题目内容
某反应的△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能小于100kJ?mol-1小 |
| B、逆反应活化能一定小于100kJ?mol-1 |
| C、正反应活化能可能等于100kJ?mol-1 |
| D、正反应活化能比逆反应活化能大100kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:根据在可逆反应过程中活化能有正反应和逆反应两种,焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能;△H>0,则反应物的总能量小于生成物的总能量.
解答:
解:A、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=100kJ?mol-1,无法确定正反应活化能的大小,故A错误;
B、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,无法确定逆反应活化能的大小,故B错误;
C、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,正反应活化能不小于100kJ?mol-1,故C错误;
D、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,即正反应活化能比逆反应活化能大100 kJ?mol-1,故D正确;
故选:D.
B、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,无法确定逆反应活化能的大小,故B错误;
C、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,正反应活化能不小于100kJ?mol-1,故C错误;
D、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,即正反应活化能比逆反应活化能大100 kJ?mol-1,故D正确;
故选:D.
点评:本题主要考查了焓变与活化能的关系,需要注意的是活化能有正反应和逆反应两种.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列对SO2和SO3的叙述正确的是( )
| A、都能跟碱溶液反应 |
| B、都是酸性氧化物,其水溶液都是强酸 |
| C、都可使品红溶液褪色,加热时红色又能再现 |
| D、通常条件下,都是无色气体,都易溶于水 |
SO2是常见的大气污染物之一.我国规定空气中其含量不得超过0.02mg/L.下列措施,能够减少SO2排放量的是( )
①用天然气代替煤炭作民用燃料
②提高热能利用率
③硫酸厂采用更好的催化剂使SO2转化为SO3
④使用CS2萃取煤炭中的硫
⑤燃煤中加入生石灰后使用.
①用天然气代替煤炭作民用燃料
②提高热能利用率
③硫酸厂采用更好的催化剂使SO2转化为SO3
④使用CS2萃取煤炭中的硫
⑤燃煤中加入生石灰后使用.
| A、全部 | B、①②⑤ |
| C、①③⑤ | D、①③④ |
下列物质间的反应,其能量变化符合如图的是( )


| A、铁与硫粉在加热条件下的反应 |
| B、灼热的碳与二氧化碳反应 |
| C、Ba(OH)2?8H2O晶体和NH4Cl晶体混合 |
| D、碳酸钙的分解 |
下列微粒的核外电子的表示方法中正确的是( )
A、基态碳原子的电子排布图 |
B、基态铜原子核外的3d、4s轨道内电子排布图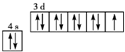 |
| C、Cl的外围电子排布式3s13p6 |
| D、Fe2+的电子排布式1s22s22p63s23p63d6 |
下列关于铯及其化合物的说法中,不正确的( )
| A、氢氧化铯是一种强碱,易溶于水 |
| B、铯与水或酸剧烈反应,都能生成氢气 |
| C、碳酸铯用酒精灯加热可以生成氧化铯和CO2 |
| D、硫酸铯、碳酸铯、硝酸铯都易溶于水 |
X、Y、Z三种元素,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子数总和为14,而质子数总和为28,则三种元素为( )
| A、N、P、O |
| B、N、C、Si |
| C、B、Mg、Al |
| D、C、N、P |
 如图是某一短周期主族元素最高价氧化物水化物某相同浓度稀溶液与原子半径的关系示意图,则下列说法正确的是( )
如图是某一短周期主族元素最高价氧化物水化物某相同浓度稀溶液与原子半径的关系示意图,则下列说法正确的是( )| A、原子序数:X>Z>W |
| B、气态氢化物的稳定性:N>R |
| C、Y和W形成共价化合物 |
| D、X和Z两者最高价氧化物对应的水化物能相互反应 |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X的性质的描述中正确的是( )
| A、X单质易与水反应 |
| B、X形成的氧化物易与水反应生成酸 |
| C、X易形成氧化物XO |
| D、XH4的稳定性比SiH4的低 |