题目内容
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是

A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
【答案】A
【解析】
A和C.平衡后加入催化剂能同等倍数的增大正、逆反应速率,所以平衡不会移动,所以A正确,C错误;
B.增大反应物O2的浓度,正反应速率增大,逆反应速率瞬间不变,所以B错误;
D.该反应后气体系数减小,所以增大压强,反应速率增大,平衡正反应方向移动,SO2的转化率增大,所以D错误;
故选A。

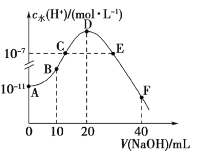
【题目】室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
|
| ||
① | 0.1 | 0.1 | 9 |
② |
| 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应的溶液中:![]()
B.实验①反应的溶液中:![]()
C.实验②反应的溶液中:![]()
D.实验②反应的溶液中:![]()
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
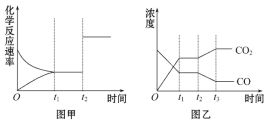
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。