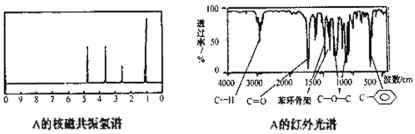
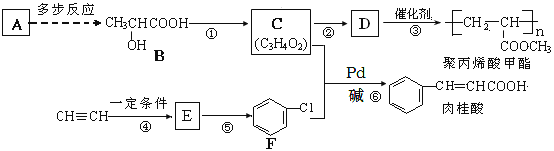
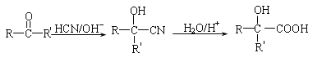
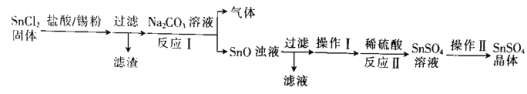
题目内容
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)= 2C3H5(ONO2)3(l) △H1;
H2(g)+ ![]() O2(g)=H2O(g) △H2 ; C(s)+O2(g)=CO2(g) △H3
O2(g)=H2O(g) △H2 ; C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
A.12△H3+10△H2﹣2△H1B.2△H1﹣10△H2﹣12△H3
C.12△H3﹣10△H2﹣2△H1D.△H1﹣10△H2﹣12△H3
【答案】A
【解析】
已知:
①6C(s)+5H2(g)+3N2(g)+9O2(g)= 2C3H5(ONO2)3(l) △H1
②H2(g)+ ![]() O2(g)=H2O(g) △H2
O2(g)=H2O(g) △H2
③C(s)+O2(g)=CO2(g) △H3
由盖斯定律:10×②+12×③-2×①得:4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)
△H=12△H3+10△H2-2△H1;
答案选A。

【题目】高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________。
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为________。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________。