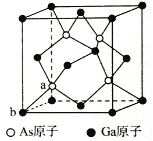
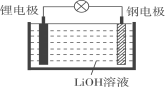
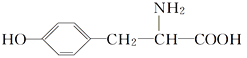题目内容
【题目】下列各组物质,化学键类型相同、晶体类型也相同的是
A. SO2和SiO2 B. CO2和H2S C. NaCl和HCl D. CCl4和KCl
【答案】B
【解析】A. 固体SO2是分子晶体和SiO2是原子晶体,都只含共价键,但晶体类型不同,故A错误;B. 固体CO2和H2S都是分子晶体,CO2和H2S都只含有共价键,故B正确;C. NaCl是离子晶体,只含有离子键,固体HCl是分子晶体,只含有共价键,故C错误;D. 固体CCl4是分子晶体,只含有共价键,KCl是离子晶体,只含有离子键,故D错误;综上分析,本题答案为B。

【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。