题目内容
【题目】已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1)FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL该溶液于锥形瓶中,用cmol/L的K2Cr2O7酸性溶液(用稀硫酸酸化)滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
【答案】 )Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ MgO或Mg(OH)2或MgCO3等 2.6×10-9 mol/L 在干燥的HCl气流中加热脱水 2Fe2++2H2C2O4+Cr2O72-+10H+=2Fe3++4CO2↑+2Cr3++7H2O
Fe(OH)3(胶体)+3H+ MgO或Mg(OH)2或MgCO3等 2.6×10-9 mol/L 在干燥的HCl气流中加热脱水 2Fe2++2H2C2O4+Cr2O72-+10H+=2Fe3++4CO2↑+2Cr3++7H2O ![]() 或
或![]() ×100% 或
×100% 或![]() %
%
【解析】本题主要考查铁的化合物的性质。
(1)FeCl3溶液可用做净水剂,其净水原理为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,Fe(OH)3胶体可以凝聚水中悬浮物。
Fe(OH)3(胶体)+3H+,Fe(OH)3胶体可以凝聚水中悬浮物。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入MgO或Mg(OH)2或MgCO3等调节溶液的pH=4,c(OH-)=1×10-10mol/L,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=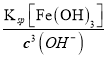 =2.6×10-9 mol/L。
=2.6×10-9 mol/L。
(3)FeCl3可以水解,为了抑制FeCl3的水解由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:在干燥的HCl气流中加热脱水。
(4)①滴定时反应的离子方程式为2Fe2++2H2C2O4+Cr2O72-+10H+=2Fe3++4CO2↑+2Cr3++7H2O。
②该草酸亚铁样品的纯度为cmol/L×VmL×2×144g/mol×250/20/(wg)= ![]() 或
或![]() ×100% 或
×100% 或![]() %。
%。

 习题精选系列答案
习题精选系列答案