题目内容
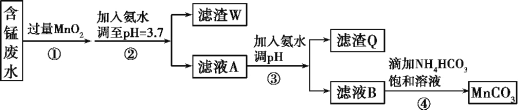
【题目】MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3:
已知:几种金属离子沉淀的pH如下表。
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
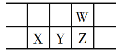
(1)①中加入过量MnO2的作用是___,滤渣W的成分是___。
(2)过程③中,调pH的目的是___。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是___。
(4)过程④中得到纯净MnCO3的操作方法是___,该过程中副产品的化学式是___。
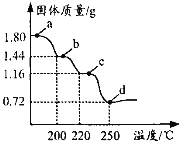
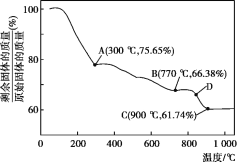
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。
【答案】将Fe2+氧化为Fe3+ Fe(OH)3和MnO2 使Cu2+完全沉淀为Cu(OH)2 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 过滤、洗涤、干燥 NH4Cl 1∶2 Mn3O4和MnO
【解析】
⑴在过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,过量的MnO2也以固体形式存在,通过调节溶液pH值将铁离子沉淀。
⑵过程③中,调pH是将Cu2+转化为沉淀除去。
⑶过程④中主要是Mn2+与HCO3-反应生成CO2和碳酸锰。
⑷过程④中得到纯净MnCO3的操作方法是过滤、洗涤、干燥,根据离子守恒因此得到还有副产物。
⑸根据分解后得到的产物质量进行计算。
⑴在过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,在过程②中,向溶液中加入氨水,调节溶液的pH=3.7,这时溶液中的Fe3+会形成Fe(OH)3沉淀,过量的MnO2也以固体形式存在,故答案为:将Fe2+氧化为Fe3+;Fe(OH)3和MnO2。
⑵过程③中,调pH是将Cu2+转化为沉淀除去,故答案为:使Cu2+完全沉淀为Cu(OH)2。
⑶过程④中,反应会有CO2生成,故反应的离子方程式为Mn2++2HCO3-=MnCO3↓ + CO2↑ +H2O,故答案为:Mn2++2HCO3-=MnCO3↓ + CO2↑ +H2O。
⑷过程④中得到纯净MnCO3的操作方法是过滤、洗涤、干燥,实验流程中,氯离子未除去,加入铵根离子,则副产品为NH4Cl,故答案为:过滤、洗涤、干燥;NH4Cl。
⑸设MnCO3的物质的量为1mol,则其质量为115g,A点剩余固体质量为115g×75.65% ≈ 87g,减少的质量为115g-87g=28g,可知MnCO3失去的组成为CO,故剩余固体的成分为MnO2,n(Mn)∶n(O)为1∶2。C点剩余固体质量为115g×61.74%≈71g,根据锰元素守恒知m(Mn)=55g,则m(O)=71g-55g=16g,则n(Mn)∶n(O)=![]() ∶
∶![]() =1∶1,故剩余固体的成分为MnO;同理可求出B点剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。
=1∶1,故剩余固体的成分为MnO;同理可求出B点剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。

 名校课堂系列答案
名校课堂系列答案