题目内容
【题目】有人设想用SO2制取少量硫酸,其装置如图所示: 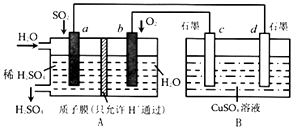
①H+移向极(填“a”或“b”),c极的电极名称是 ,
②a极发生的电极反应式为 .
③c极发生的电极反应式为 .
④标准状况下,A装置吸收3.36LSO2时,B装置中溶液最多减重g.(装置中气体的溶解性忽略不计)
【答案】b;阳极;SO2﹣2e﹣+2H2O=4H++SO42﹣;4OH﹣﹣4e﹣=O2+2H2O;12
【解析】解:①根据以上分析,A装置为原电池,H+移向正极b,与b相连的c为阳极,所以答案是:b;阳极;②a通二氧化硫为负极发生氧化反应,电极反应式为SO2﹣2e﹣+2H2O=4H++SO42﹣ , 所以答案是:SO2﹣2e﹣+2H2O=4H++SO42﹣;③与b相连的c为阳极失电子发生氧化反应,电极反应式为4OH﹣﹣4e﹣=O2+2H2O,所以答案是:4OH﹣﹣4e﹣=O2+2H2O;④根据a通二氧化硫为负极发生氧化反应,电极反应式为SO2﹣2e﹣+2H2O=4H++SO42﹣ , 当标准状况下,A装置吸收3.36LSO2时,则转移电子数为: ![]() ×2=0.3mol,B属于电解池即惰性电极电极硫酸铜溶液,阳极电极反应式为4OH﹣﹣4e﹣=O2+2H2O放出氧气,阴极Cu2++2e﹣=Cu析出铜,所以B装置中溶液最多减重
×2=0.3mol,B属于电解池即惰性电极电极硫酸铜溶液,阳极电极反应式为4OH﹣﹣4e﹣=O2+2H2O放出氧气,阴极Cu2++2e﹣=Cu析出铜,所以B装置中溶液最多减重 ![]() ×32+
×32+ ![]() ×64=12(g),所以答案是:12.
×64=12(g),所以答案是:12.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1
【题目】根据如表数据,下列选项正确的是( )
化学式 | CH3COOH | H2SO3 | NH3H2O |
电离常数K(25℃) | Ka=1.8×10﹣5 | Ka1=1.23×10﹣2;Ka2=6.6×10﹣8 | Kb=1.8×10﹣5 |
A.Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32﹣+2CH3COOH=SO2↑+H2O+2CH3COO﹣
B.25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离被促进
C.NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2
D.0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO﹣)+c(OH﹣)
