题目内容
能源问题日益成为制约经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。



图1 图2 图3
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
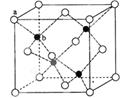
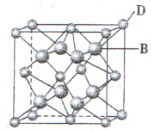
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为 。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、碲化镉及铜铟硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②二氧化硒分子的空间构型为 。
(4)金属酞菁配合物可应用于硅太阳能电池中,一种金属镁酞菁配合物的结构如图3,请在图中用箭头表示出配位键的位置。



图1 图2 图3
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为 。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、碲化镉及铜铟硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②二氧化硒分子的空间构型为 。
(4)金属酞菁配合物可应用于硅太阳能电池中,一种金属镁酞菁配合物的结构如图3,请在图中用箭头表示出配位键的位置。
(1) 1s22s22p63s23p63d84s2或[Ar]3d84s2 (2)sp2 90NA 3:1
(3)①> ②折线型(V型) (4)
(3)①> ②折线型(V型) (4)

试题分析::(1)镍是28号元素,原子核外有28个电子,根据构造原理可写出镍原子的核外电子排布式。
(2)根据富勒烯(C60)的结构可以看出每个C原子和其它三个C原子成键,为三个σ键和一个π键,由此判断杂化类型为sp2;根据C60分子中每个C原子和其它C原子形成三个σ键,平均一个C原子占有
 个σ键来计算σ键的数目,所以1mol C60分子中σ键的数目=
个σ键来计算σ键的数目,所以1mol C60分子中σ键的数目= ×60×NA=90NA;根据均摊法,该晶胞独立分得K原子:2×6×
×60×NA=90NA;根据均摊法,该晶胞独立分得K原子:2×6× =6,独立分得C60:8×
=6,独立分得C60:8× +1=2。
+1=2。(3)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se。
②SeO2分子中心原子价层电子对数=(6+0)/2=3,且含有孤立电子对,所以属于V形。
(4)配位键由提供孤电子对的原子指向提供空轨道的原子,“—N=”有孤电子对,与Mg2+形成配位键,“—N—”无孤立电子对,与Mg2+形成共价键。

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目


 在过量氨水中易转化为
在过量氨水中易转化为 。写出
。写出 的价层电子排布图____。
的价层电子排布图____。 中
中 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中 键和
键和 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
 键的个数为 。
键的个数为 。 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用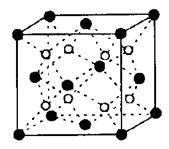
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。