题目内容
硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH4)2SO4·FeSO4·6H2O],相对分子质量为392,是常用的分析试剂.在实验室,将FeSO4和(NH4)2SO4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体.某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品.请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
________.
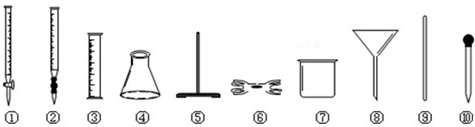
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+.离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O.滴定时必须选用的仪器有________(从下图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂?________.若需要,请指出加什么指示剂;若不需要,请说明理由.________.

(3)取莫尔盐产品23.520 g,配成250 mL溶液,取出25.00 mL用0.0500 mol/L KMnO4溶液滴定,消耗KMnO4溶液19.50 mL,则产品中莫尔盐的质量分数________.
解析:
|
(1)预测现象:生成白色沉淀,迅速变成灰绿色,最终变成红褐色;同时放出大量刺激性且能使红色石蕊试纸变蓝得气体.(2分) (2)必须选用的仪器有①④⑤⑥;(2分,①④⑤⑥⑦也给分,其它答案均不给分); 不需要(1分).Fe2+完全反应,过量的高锰酸钾将使溶液出现紫色,可指示终点.(1分) (3)产品中莫尔盐的质量分数为81.3%.(2分,数值在81.3±0.3%,且三位或四位有效数字均给分;但两位或五位有效数字只给1分). |


 【实验化学】
【实验化学】