题目内容
①某二元酸(化学式用H2B表示)在水中的电离方程式:
H2B═H++HB-,HB-?H++B2-,
则在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 .
A.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
B.c(OH-)=c(H+)+c(HB-)+2c(H2B)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
若已知0.1mol/L NaHB溶液的pH=2,则该溶液中各种离子浓度由大到小的顺序是 .
②在含有AgCl固体的饱和溶液中,AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq).
若已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银固体分别放入:
A.100mL蒸馏水中; B.100mL 0.2mol/L AgNO3溶液中;
C.100mL 0.1mol/L氯化铝溶液中; D.100mL 0.2mol/L 盐酸
则相同温度下所得溶液中c(Ag+)由大到小的顺序是 (填写序号).
H2B═H++HB-,HB-?H++B2-,
则在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
B.c(OH-)=c(H+)+c(HB-)+2c(H2B)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
若已知0.1mol/L NaHB溶液的pH=2,则该溶液中各种离子浓度由大到小的顺序是
②在含有AgCl固体的饱和溶液中,AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq).
若已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银固体分别放入:
A.100mL蒸馏水中; B.100mL 0.2mol/L AgNO3溶液中;
C.100mL 0.1mol/L氯化铝溶液中; D.100mL 0.2mol/L 盐酸
则相同温度下所得溶液中c(Ag+)由大到小的顺序是
考点:离子浓度大小的比较,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:①根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答;据离子是否电离确定钠离子和酸式酸根离子浓度大小,根据溶液的酸碱性确定氢离子和氢氧根离子浓度相对大小,根据离子来源确定氢离子和B离子相对大小;
②氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积分别计算.
②氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积分别计算.
解答:
解:①在Na2B中存在水解平衡:B2-+H2O=HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.HB-不会进一步水解,所以溶液中没有H2B分子,根据物料守恒得c(B2-)+c(HB-)=0.1mol?L-1,故A错误;
B.根据质子守恒:c(OH-)=c(H+)+c(HB-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故C正确;
D.把质子守恒和电荷守恒式相加得:c(Na+)=2c(B2-)+2c(HB-),故D正确;
钠离子不电离,HB-能电离,所以c(Na+)>c(HB-),根据溶液的pH=2可知溶液呈酸性,则c(H+)>c(OH-),水和HB-都电离出氢离子,则c(H+)>c(B2-),所以该溶液中离子浓度大小顺序为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),
故答案为:CD;c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-);
②A.100mL蒸馏水中,氯化银正常溶解;
B.100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,
C.100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度为:6×10-10mol/L;
D.100mL 0.2mol?L-1盐酸溶液中氯离子浓度为0.2mol/L,银离子浓度为0.9×10-9mol/L;综上所述大小顺序为:BADC,
故答案为:BADC.
A.HB-不会进一步水解,所以溶液中没有H2B分子,根据物料守恒得c(B2-)+c(HB-)=0.1mol?L-1,故A错误;
B.根据质子守恒:c(OH-)=c(H+)+c(HB-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故C正确;
D.把质子守恒和电荷守恒式相加得:c(Na+)=2c(B2-)+2c(HB-),故D正确;
钠离子不电离,HB-能电离,所以c(Na+)>c(HB-),根据溶液的pH=2可知溶液呈酸性,则c(H+)>c(OH-),水和HB-都电离出氢离子,则c(H+)>c(B2-),所以该溶液中离子浓度大小顺序为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),
故答案为:CD;c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-);
②A.100mL蒸馏水中,氯化银正常溶解;
B.100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,
C.100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度为:6×10-10mol/L;
D.100mL 0.2mol?L-1盐酸溶液中氯离子浓度为0.2mol/L,银离子浓度为0.9×10-9mol/L;综上所述大小顺序为:BADC,
故答案为:BADC.
点评:本题考查弱电解质电离、溶度积的计算应用等知识,题目难度中等,注意①中该酸第一步完全电离,第二步部分电离,导致HB-能电离但不水解,为易错点,意把握溶液中的守恒关系.

练习册系列答案
相关题目
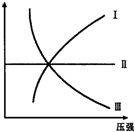 如图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指( )
如图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指( )①N2(g)+3H2(g)?2NH3(g);△H=-Q
②H2(g)+I2(g)?2HI(g);△H=+Q
③CO(g)+2H2(g)?H3OH(g);△H=-Q
④2SO3(g)2?2SO2(g)+O2(g);△H=+Q.
| A、平衡混合气中一种生成物的百分含量 |
| B、平衡混合气中一种反应物的百分含量 |
| C、平衡混合气中一种生成物的转化率 |
| D、平衡混合气中一种反应物的转化率 |
下列事实可以说明“苯分子结构中不存在碳碳单键和碳碳双键交替相连结构”的是( )
| A、苯能与H2发生加成反应物 |
| B、苯不能使溴水褪色 |
| C、溴苯没有同分异构体 |
| D、邻二溴苯只有一种 |

 ),其反应类型是
),其反应类型是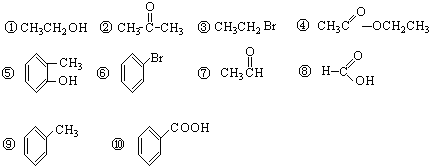
 和
和 :
: ,
, 和C6H12(已烯):
和C6H12(已烯):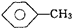 ,CCl4和乙醇
,CCl4和乙醇 的系统命名:
的系统命名: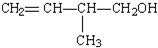 的键线式:
的键线式: