题目内容
 以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
| Mg(OH)2 | 8.0 | 12.4 |
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:______.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:______.
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为______≤pH<______.
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):______.
解:(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O,
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)因FeS2将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,用化合价升价法配平方程式,
故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,反应的方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3),
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3);
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,故答案为:2.8≤pH<3.0;
(5)滤液未沉淀的离子为Na+、Mg2+、Al3+,Al3+和NaOH反应:Al3++3OH-=Al(OH)3↓,若NaOH过量,NaOH与Al(OH)3反应:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
分析:(1)氧化铁属于碱性氧化物,与酸反应生成盐和水;
(2)根据氧化还原反应用化合价升价法配平方程式,
(3)NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
(4)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀;
(3)滤液未沉淀的离子为Na+、Mg2+、Al3+,根据Al3+和过量的NaOH反应;
点评:本题以铁及其化合物为载体,以流程图形式考查了氧化还原反应知识、元素化合物的知识.
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)因FeS2将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,用化合价升价法配平方程式,
故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,反应的方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3),
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3);
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,故答案为:2.8≤pH<3.0;
(5)滤液未沉淀的离子为Na+、Mg2+、Al3+,Al3+和NaOH反应:Al3++3OH-=Al(OH)3↓,若NaOH过量,NaOH与Al(OH)3反应:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
分析:(1)氧化铁属于碱性氧化物,与酸反应生成盐和水;
(2)根据氧化还原反应用化合价升价法配平方程式,
(3)NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
(4)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀;
(3)滤液未沉淀的离子为Na+、Mg2+、Al3+,根据Al3+和过量的NaOH反应;
点评:本题以铁及其化合物为载体,以流程图形式考查了氧化还原反应知识、元素化合物的知识.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:

(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
|
完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有______________________;
(4)简述洗涤过程的实验操作 ;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(已知相对原子质量:O 16 S 32 Fe 56 )
 (2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
(2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.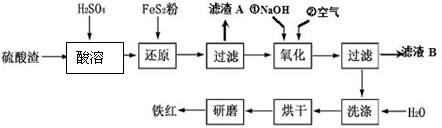
 和
和
