题目内容
不能说明X的电负性比Y的大的是
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
C
解析试题分析:电负性大小可以作为判断元素的金属性和非金属性强弱的尺度,非金属性越强,电负性越大,据此可以判断。A、与H2化合时X单质比Y单质容易,这说明X的非金属性强于Y的非金属性,因此X的电负性比Y的大,A可以作为判断依据;B、非金属性越强,最高价氧化物对应水化物的酸性越强,所以X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强可以说明X的电负性比Y的大,即B可以作为判断依据;C、X原子的最外层电子数比Y原子的最外层电子数多不能说明X的非金属性强于Y的非金属性,因此不能判断二者的电负性强弱,C不能作为判断依据;D、非金属性强的单质可以置换出盐溶液中非金属性弱的单质,所以X单质可以把Y从其氢化物中置换出来,可以说明X的电负性比Y的大,即D可以作为判断依据,答案选C。
考点:考查电负性强弱的判断依据

下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是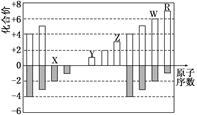
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R>W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。下列说法错误的是
| A.X、Y、Z都是非金属元素 |
| B.X、Y的最高价氧化物所对应的水化物酸性X>Y |
| C.X、Y、Z的电负性大小顺序是Z>X>Y |
| D.由X、Y、Z三种元素可形成多种离子化合物 |
据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
| A.20Ne和22Ne的中子数相同 | B.22Ne的质子数为12 |
| C.20Ne和22Ne的质量数相同 | D.20Ne和22Ne互为同位素 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如右图所示。下列说法正确的是( )
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.元素Y、W的气态氢化物的稳定性,前者比后者差 |
| C.离子Y2-和Z3+的离子半径,后者比前者大 |
| D.元素W的最高价氧化物对应的水化物酸性比Q的强 |
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是
| A.原子半径Z<M |
| B.Y的最高价氧化物对应水化物的酸性比X 的弱 |
| C.X 的最简单气态氢化物的热稳定性比Z的小 |
| D.Z位于元索周期表中第2 周期、第ⅥA族 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
| A.由mXa+与nYb-,得m+a=n-b |
| B.X2-的还原性一定大于Y- |
| C.X,Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.元素非金属性:Z> Y > X | B.最高价氧化物水化物酸性:Z > Y |
| C.原子半径:Z < Y < X | D.气态氢化物的稳定性:Z < Y < X |