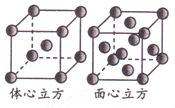
题目内容
【题目】某化学兴趣小组用只含有Al、Fe、Cu的工业废料制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案如下:
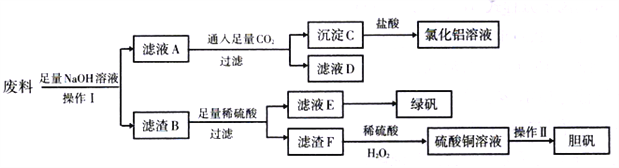
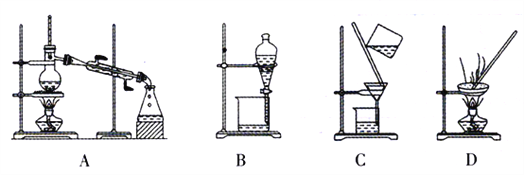
(1)操作I应选择以下装置中的_____________(填正确答案编号)。
(2)滤液D中的溶质主要是________________(写化学式)。
(3)写出沉淀C与盐酸反应的离子方程式:________________。
(4)滤液E露置在空气中一段时间后,检测出溶液中含Fe2+,原因是________________。
(5)写出滤渣F与稀硫酸、H2O2制硫酸铜的反应方程式_______________________,该反应与滤渣F跟浓硫酸直接反应相比,其优点是_________________________________。
(6)操作II步骤有蒸发浓缩、_______________、过滤洗涤、自然干燥。
【答案】 C NaHCO3 Al(OH)3+3H+=Al3++3H2O Fe2+具有强还原性,易被空气中的氧气氧化成Fe3+ Cu+H2SO4+H2O2=CuSO4+2H2O 无污染大气的SO2气体产生 冷却结晶
【解析】(1)操作I得到滤液A和滤渣B,属于过滤,A~D四种操作分别是蒸馏、分液、过滤、蒸发,答案选C。(2)只有铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,即A中含有偏铝酸钠,通入足量二氧化碳生成碳酸氢钠和氢氧化铝,因此滤液D中的溶质主要是NaHCO3。(3)沉淀C是氢氧化铝,与盐酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。(4)滤液E最终得到绿矾,说明是硫酸亚铁溶液。由于Fe2+具有强还原性,易被空气中的氧气氧化成Fe3+,所以露置在空气中一段时间后,检测出溶液中含Fe2+。(5)滤渣B中含有铁和铜,铜与稀硫酸不反应,则滤渣F是铜,与稀硫酸、H2O2制硫酸铜的反应方程式为Cu+H2SO4+H2O2=CuSO4+2H2O,该反应与滤渣F跟浓硫酸直接反应相比,其优点是无污染大气的SO2气体产生,且硫酸的利用率高。(6)由溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥才可得到。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
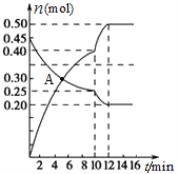
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
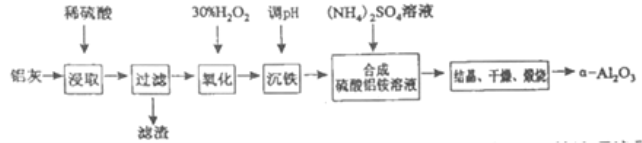
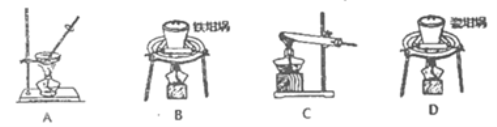
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号).
(2)流程中加入H2O2有气体产生,原因是___________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.己知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的____调节溶液pH(填字母),调节pH的范围为_____。
a.A12O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
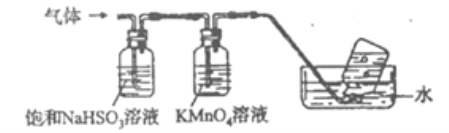
①集气瓶中收集到的气体是______(填化学式).
②装有KMnO4溶液洗气瓶的作用是________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________,写出硫酸铝铵加入足量该试剂的离子方程式_________________。