题目内容
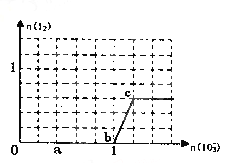
【题目】已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,请回答下列问题
下列问题:
(1)a点处的氧化产物是_________(填化学式,下同),还原产物是_______,a点对应的离子方程式为_____。
(2)当n(I2)达到最大值时,n(IO3-)对应的最小值为____mol,此时反应的离子方程式是_____________。
(3)当溶液中的I-为0.4mol时,加入的KIO3为______mol。
(4)若向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为____________。
【答案】 SO42- I- IO3-+3HSO3-=I-+3SO42-+3H+ 1.2 IO3-+5I-+6H+=3I2+3H2O 1.12或0.4 2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
【解析】在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,还原性HSO3->I-,则首先发生反应:IO3-+3HSO3-=I-+3SO42-+3H+,HSO3-反应完全后,继续加入KIO3,由于氧化性IO3->I2,再发生反应:IO3-+5I-+6H+=3I2+3H2O。
(1).由图可知,a点没有生成碘,故发生的反应是:IO3-+3HSO3-=I-+3SO42-+3H+,反应中S元素化合价升高,还原剂是HSO3-,氧化产物是SO42-,I元素的化合价降低,IO3-是氧化剂,I-是还原产物,故答案为:SO42-;I-;IO3-+3HSO3-=I-+3SO42-+3H+;
(2).由图可知,b点到c点生成I2,则b点到c点发生反应:IO3-+5I-+6H+=3I2+3H2O,根据图象中的坐标数据可知,当n(I2)达到最大值时, n(IO3-)对应的最小值为1.2mol,故答案为:1.2;IO3-+5I-+6H+=3I2+3H2O;
(3).当溶液中的I-为0.4mol时,有两种情况:一是只发生反应IO3-+3HSO3-=I-+3SO42-+3H+,生成I-为0.4mol,根据碘原子守恒n(KIO3)=n(I-)=0.4mol;二是HSO3-反应完毕后,又发生IO3-+5I-+6H+=3I2+3H2O,剩余I-为0.4mol,3molNaHSO3消耗1molKIO3、生成1mol I-,故反应IO3-+5I-+6H+=3I2+3H2O中消耗的I-为1mol-0.4mol=0.6mol,消耗KIO3的物质的量为0.6mol×![]() =0.12mol,则共加入KIO3的物质的量为1mol+0.12mol=1.12mol,故答案为:1.12或0.4;
=0.12mol,则共加入KIO3的物质的量为1mol+0.12mol=1.12mol,故答案为:1.12或0.4;
(4).向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,HSO3-被氧化为SO42-,开始时KIO3过量,由于氧化性IO3->I2,则KIO3反应时不能生成I-,而是生成I2,反应离子方程式为:2IO3-+5HSO3-=I2+5SO42-+H2O+3H+,故答案为:2IO3-+5HSO3-=I2+5SO42-+H2O+3H+。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案