题目内容
X、Y、Z为原子序数依次减小的三种元素.X与Y电子层数相同;Y和Z的最外层电子数相同.这三种元素原子的最外层电子数之和为19,原子序数之和为41,则:X是
Cl
Cl
,Y是S
S
,Z是O
O
.分析:根据X、Y、Z的电子层结构确定它们在元素周期表中的位置,再根据给定的数据和元素周期表的结构列式计算.
解答:解:根据题意,X与Y电子层数相同,即X与Y在同一周期,Y和Z的最外层电子数相同,即Y和Z在同一主族,又因为X、Y、Z原子序数依次减小,则Z在Y的上一个周期,X在Y的右边,即三者的位置关系为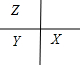 .
.
设Y的最外层电子数为Y,则Z和X的最外层电子数分别为Y和(Y+1),则Y+Y+(Y+1)=19,即Y=6,Z和Y在第VIA,X在第VIIA.
若设Y的原子序数为n,因为Z与Y同主族原子序数相差8,则Z的原子序数为(n-8),因为Y与X同周期,原子序数相差1,则X的原子序数为(n+1),即n+(n-8)+(n+1)=41,n=16,故Y是S,X是Cl,Z是O.
故答案为:Cl;S;O.
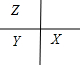 .
.设Y的最外层电子数为Y,则Z和X的最外层电子数分别为Y和(Y+1),则Y+Y+(Y+1)=19,即Y=6,Z和Y在第VIA,X在第VIIA.
若设Y的原子序数为n,因为Z与Y同主族原子序数相差8,则Z的原子序数为(n-8),因为Y与X同周期,原子序数相差1,则X的原子序数为(n+1),即n+(n-8)+(n+1)=41,n=16,故Y是S,X是Cl,Z是O.
故答案为:Cl;S;O.
点评:本题把原子的电子层排布与元素周期表的结构结合起来,考查的知识比较灵活,难度较大,解答这类题的一般思路是:根据题目信息确定在周期表的位置,然后再根据其他信息作出判断.

练习册系列答案
相关题目