题目内容
11.把一端弯成螺旋状的铜丝放在酒精灯火焰上加热,看到铜丝表面变黑,再迅速插入盛有乙醇的试管中,看到铜丝表面变红色;反复多次后,试管中生成有特殊气味的物质,反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;乙醇中官能团的名称为羟基.分析 乙醇分子含有羟基,在铜做催化剂条件下,能够被氧气氧化生成乙醛,乙醛具有刺激性气体,据此解答.
解答 解:乙醇中官能团的名称为羟基,在铜做催化剂条件下,能够被氧气氧化生成乙醛,方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,乙醛具有刺激性气体,铜丝在反应中先变黑再变红色;
故答案为:变红色;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;羟基.
点评 本题考查了乙醇性质,熟悉乙醇的结构及性质是解题关键,注意铜在反应中起催化剂作用,题目难度不大.

练习册系列答案
相关题目
1.下列实验操作与实验目的不相符的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向醋酸溶液中加入少量石灰石固体 | 验证醋酸与碳酸的酸性强弱 |
| B | 在淀粉溶液中加入20%的稀H2SO4水解后,立即加入银氨溶液做银镜反应实验 | 验证淀粉水解是否有葡萄糖生成 |
| C | 在CuSO4溶液中加入过量NaOH溶液振荡,立即加入某同学尿液并加热 | 验证该同学是否患有糖尿病 |
| D | 在乙醇溶液中插入一根灼热变黑的铜丝 | 验证乙醇是否被氧化成醛 |
| A. | A | B. | B | C. | C | D. | D |
2. 有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
(1)D、E、F的简单离子半径由大到小的顺序是(用化学式表示,下同)S2->Cl->Al3+;
(2)D、E元素形成的化合物的水溶液呈酸性,该溶液中离子浓度的大小顺序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式:H++HSO-3=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为30%;
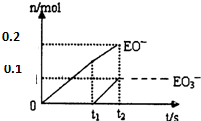
(5)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH=CH3CH2ONa+H2↑.
 有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E元素形成的化合物的水溶液呈酸性,该溶液中离子浓度的大小顺序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式:H++HSO-3=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH=CH3CH2ONa+H2↑.
19.潮湿的Cl2,新制的氯水,次氯酸能使有色布条褪色,其原因是这些物质中含有( )
| A. | HCl | B. | Ca(ClO)2 | C. | Cl2 | D. | HClO |
6.下列化学方程式中,书写不正确的是( )
| A. | 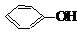 +NaOH→ +NaOH→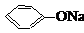 +H2O +H2O | B. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | ||
| C. | CH2=CH2+H2O→CH3CH2OH | D. | CH4+Cl2→CH2Cl2+H2 |
20.NaOH溶液中混有少量Na2CO3,除去Na2CO3的正确方法是( )
| A. | 加适量BaCl2溶液,过滤 | B. | 加适量澄清石灰水,过滤 | ||
| C. | 加热使Na2CO3和水反应 | D. | 加适量Ca(HCO3)2溶液,过滤 |