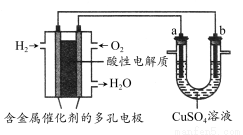
题目内容
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
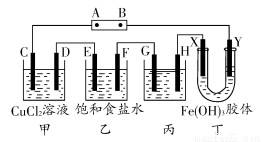
(1)A极为电源的________极。
(2)甲装置中电解反应的总化学方程式是______________。
(3)乙装置中F极附近显红色的原因是______________。
(4)欲用丙装置精炼铜,G应该是________(填“纯铜”或“粗铜”),精炼液的成分是______________________。
(5)已知氢氧化铁胶体中含有带正电荷的红褐色的粒子,那么装置丁中的现象是:
____________________________________________________________。
(1)正 (2)CuCl2 Cu+Cl2↑
Cu+Cl2↑
(3)F极为阴极,H+放电,促进了水的电离,生成了OH-,使酚酞显红色
(4)粗铜 硫酸铜溶液
(5)Y极附近红褐色变深
【解析】本题的突破口为“F极附近显红色”,显红色的原因是生成了OH-,而OH-是由于水电离出的H+放电,促进了水的电离而生成的。H+放电说明该极为阴极,B极为负极,则A极为正极。至此,前3问可以解决。
(4)电解精炼铜时应将粗铜作阳极,精铜作阴极,CuSO4溶液作电解质溶液。通电后,阳极(粗铜)的主要反应是Cu-2e-=Cu2+。当粗铜的表面出现比铜活泼的金属时,它们也会放电。但生成的阳离子的氧化性比铜离子弱,不可能在阴极上析出,故留在溶液中。而粗铜中活泼性比铜弱的金属会在阳极的底部沉积,成为阳极泥。所以,阴极(精铜)的反应只有Cu2++2e-=Cu,这样就可以在阴极上获得纯净的金属铜。(5)氢氧化铁胶粒带正电荷,向阴极(Y极)移动,则该极附近红褐色变深。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目