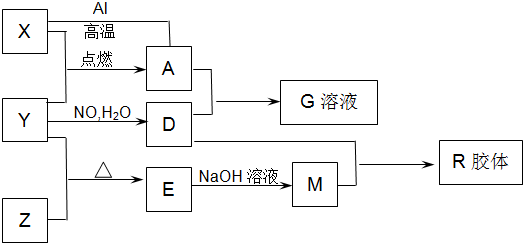
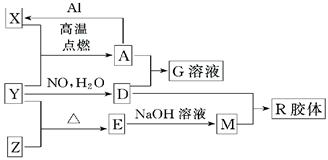
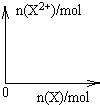题目内容
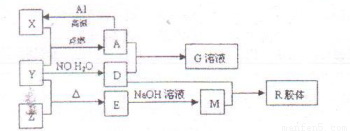
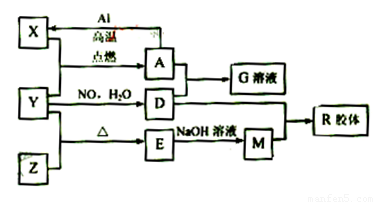
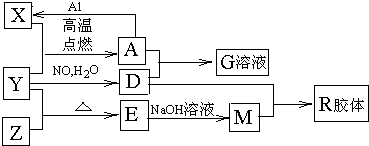
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
 回答下列问题:
回答下列问题:
(1)组成单质X的元素在周期表中的位置是 ;M中存在的化学键类型为 ;
(2)一定条件下,Z与H2反应生成ZH4的结构式为 。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式: 。
(4)写出M和D的稀溶液反应生成R的离子方程式:
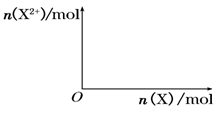
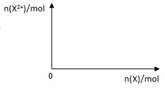
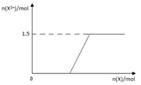
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
(1)第4周期第Ⅷ族
离子键 共价键 (2) 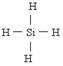
(3)8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8aKJ/mol
(4)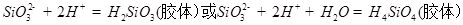
(5)
【解析】本题是无机框图题,根据是找准突破点。A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应,所以A是四氧化三铁,E是二氧化硅。则X是铁,Y是氧气,Z是硅,D是硝酸,M是硅酸钠,R是硅酸,是硝酸铁。
(1)铁位于元素周期表的第四周期第Ⅷ族;硅酸钠是离子化合物和离子键和极性键。
(2)SiH4的结构类似于甲烷的,即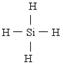 。
。
(3)考查热化学方程式的书写。
(4)硝酸的酸性强于硅酸的,所以生成R的方程式是SiO32-+2H+=H2SiO3(胶体)。
(5)铁和硝酸反应生成硝酸铁,铁过量时,在转化为硝酸亚铁,方程式是Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe=3Fe(NO3)2,所以最终生成的亚铁离子是1.5mol,因此图像是 。
。



 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O