题目内容
(2011?天津)图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去).其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
(2)一定条件下,Z与H2反应转化为ZH4.ZH4的电子式为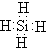
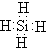 .
.
(3)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式:
(4)写出A和D的稀溶液反应生成G的离子方程式:
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值.


回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
第二周期第VIA族
第二周期第VIA族
;M中存在的化学键类型为离子键、共价键
离子键、共价键
;R的化学式是H2SiO3(或H4SiO4)
H2SiO3(或H4SiO4)
.(2)一定条件下,Z与H2反应转化为ZH4.ZH4的电子式为
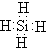
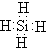
(3)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式:
8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8akJ/mol
8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8akJ/mol
.(4)写出A和D的稀溶液反应生成G的离子方程式:
3Fe3O4+28H++NO3- 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O
 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O3Fe3O4+28H++NO3- 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O
. 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值.

分析:(1)根据原子核外电子排布来确定元素在周期表中的位置,根据物质中的成键元素确定物质中的化学键类型,
(2)根据电子式的书写方法和物质中化学键类型来解答;
(3)根据热化学方程式的含义和书写规则来分析;
(4)根据硝酸的强氧化性和四氧化三铁为碱性氧化物的性质来书写;
(5)根据铁和硝酸反应的原理及其反应的过程来分析.
(2)根据电子式的书写方法和物质中化学键类型来解答;
(3)根据热化学方程式的含义和书写规则来分析;
(4)根据硝酸的强氧化性和四氧化三铁为碱性氧化物的性质来书写;
(5)根据铁和硝酸反应的原理及其反应的过程来分析.
解答:解:A俗称磁性氧化铁,即为四氧化三铁;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为铁、Y为O2、Z为Si、D为硝酸、M为硅酸钠、G为硝酸铁.
(1)根据氧原子的核外电子排布,知氧元素在周期表的第二周期第VIA族;硅酸钠中有离子键、共价键;R的化学式是
H2SiO3(或H4SiO4);故答案为:第二周期第VIA族;离子键、共价键; H2SiO3(或H4SiO4);
(2)ZH4的分子式为SiH4,其电子式为: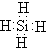
(3)根据热化学方程式的书写方法和书写原则,先写出铝和四氧化三铁反应的化学方程式,再注明状态和焓变;故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol
(4)四氧化三铁和硝酸反应是,铁元素均被氧化到最高价,硝酸中氮元素被还原到+2价,故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(5)根据铁和硝酸反应的实质,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变.故答案为:

(1)根据氧原子的核外电子排布,知氧元素在周期表的第二周期第VIA族;硅酸钠中有离子键、共价键;R的化学式是
H2SiO3(或H4SiO4);故答案为:第二周期第VIA族;离子键、共价键; H2SiO3(或H4SiO4);
(2)ZH4的分子式为SiH4,其电子式为:
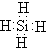
(3)根据热化学方程式的书写方法和书写原则,先写出铝和四氧化三铁反应的化学方程式,再注明状态和焓变;故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol
(4)四氧化三铁和硝酸反应是,铁元素均被氧化到最高价,硝酸中氮元素被还原到+2价,故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(5)根据铁和硝酸反应的实质,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变.故答案为:

点评:本题目是一道框图推断题,根据题干信息推出各种物质是答题的前提,然后结合所学知识来回答.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
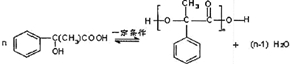
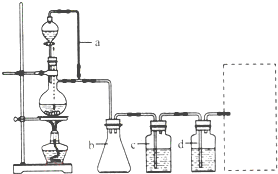 (2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
(2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:






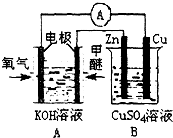 (2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.