题目内容
A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同,B是形成化合物种类最多的元素。
请回答以下问题:
(1)G在周期表的位置 ;
(2)写出D元素单质的电子式
(3)E、F形成的既有离子键又有共价键的化合物与A2E反应的方程式 ;
(4)B、D、E氢化物的稳定性从大到小的顺序(用化学式表示,下同): ;
E、G所在主族最高价氧化物对应水化物酸性最强的是 ,某种金属与其浓溶液在加热条件下可以得到一种蓝色溶液,用惰性电极电解该溶液时,阳极的电极反应式______________________;
(5)由A、B组成的化合物中,含A量最高的物质的化学式是 。
请回答以下问题:
(1)G在周期表的位置 ;
(2)写出D元素单质的电子式
(3)E、F形成的既有离子键又有共价键的化合物与A2E反应的方程式 ;
(4)B、D、E氢化物的稳定性从大到小的顺序(用化学式表示,下同): ;
E、G所在主族最高价氧化物对应水化物酸性最强的是 ,某种金属与其浓溶液在加热条件下可以得到一种蓝色溶液,用惰性电极电解该溶液时,阳极的电极反应式______________________;
(5)由A、B组成的化合物中,含A量最高的物质的化学式是 。
(1)第三周期第ⅥA族(1分)
(2)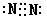 (1分)
(1分)
(3)2Na2O2 + 2H2O =" 4NaOH" + O2↑(2分)
(4) H2O> NH3 >CH4(1分); H2SO4(1分) ; 4OH-—4e- = O2↑+ 2H2O (或2H2O—4e- = O2↑+4H+)(2分)
(5) CH4(1分)
(2)
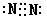 (1分)
(1分)(3)2Na2O2 + 2H2O =" 4NaOH" + O2↑(2分)
(4) H2O> NH3 >CH4(1分); H2SO4(1分) ; 4OH-—4e- = O2↑+ 2H2O (或2H2O—4e- = O2↑+4H+)(2分)
(5) CH4(1分)
试题分析:A、B、D、E、F、G为短周期元素,且原子序数依次递增。B是形成化合物种类最多的元素,推定是碳元素,A、F同主族,A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,推断出A是H,F是Na,F+与E2-核外电子排布相同,E、G同主族。可以推断出E是O,G是S,D是N,(1)G在第三周期第ⅥA族,(2) D元素单质,氮气有三对共用电子对,(3)E、F形成的既有离子键又有共价键的化合物Na2O2,A2E是水,二者反应可以制氧气,(4)C、N、O位于同一周期,非金属性逐渐增强,对应氢化物稳定性也逐渐增强;同一主族,从上至下,非金属性逐渐减弱,对应最高价氧化物对应的水化物的酸性逐渐减弱,因此为硫酸,蓝色溶液为硫酸铜溶液,阴离子移向阳极,根据放电顺序,氢氧根离子比含氧酸根离子优先放电,4OH-—4e- = O2↑+ 2H2O

练习册系列答案
相关题目
