题目内容
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=___,c(Fe2+)=___。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有___;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是___。
a.称量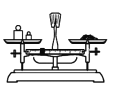 b.溶解
b.溶解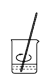 c.转移
c.转移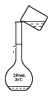 d.定容
d.定容![]()
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。___
【答案】2 0.5mol/L 100mL 容量瓶,玻璃棒 b 0.2mol/L
【解析】
(1)、(NH4)xFe(SO4)2·6H2O中Fe的化合价为+2价,SO42-的化合价为-2价, NH4+的化合价为+1价,根据化合物的化合价的代数和为0,求x的值;根据n [ (NH4)xFe(SO4)2·6H2O] =![]() ,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =
,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =![]() ,由此分析解答;
,由此分析解答;
(2)、配制100mL的莫尔盐溶液,所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL容量瓶、玻璃棒,由此分析解答;
(3)、反应H++ Fe2++ MnO4- →Fe3++Mn2++ H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子, MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为:8H++5 Fe2++ MnO4- =5Fe3++Mn2++ 4H2O,n (Fe2+)=0.5mol/L×20.00×10-3L=0.01mol,根据配平后离子反应,可得关系式: 5Fe2+~ MnO4-,由此结合相关公式分析解答。
(1) 、(NH4)xFe(SO4)2·6H2O中Fe的化合价为+2价,SO42-的化合价为-2价, NH4+的化合价为+1价,根据化合物的化合价的代数和为0可知: (+1) ×x+ (+2)+ (-2) ×2=0,解得x=2;溶液中n [(NH4)xFe(SO4)2·6H2O]=![]() ,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =
,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =![]() ,
,
故答案为:2;0.5mol/L;
(2)、配制100mL的莫尔盐溶液,所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL 容量瓶、玻璃棒;
a、称量时应左物右码,a错误;
b、溶解时搅拌,加速溶解,b正确;
c、转移时应用玻璃棒引流,c错误;
d、定容时,胶头滴管不能深入容量瓶内,d错误;
故答案为:100mL 容量瓶,玻璃棒;b;
(3)\反应H++ Fe2++ MnO4- →Fe3++Mn2++ H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子, MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为:8H++5 Fe2++ MnO4- =5Fe3++Mn2++ 4H2O,n (Fe2+)=0.5mol/L×20.00×10-3L=0.01mol,根据配平后离子反应,可得关系式: 5Fe2+~ MnO4-,n(KMnO4)![]() , c(KMnO4)
, c(KMnO4)![]() ,
,
故答案为:0.2mol/L。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案