题目内容
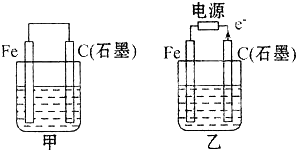
如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )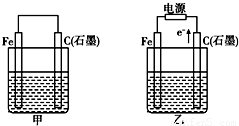
A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-═4OH-
B.若乙烧杯中盛有NaCl溶液,则乙中的总反应为2Cl-+2H2O
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-═Fe2+
D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6g CuO
【答案】分析:甲池是原电池,乙池是电解池,甲池中铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上得电子发生还原反应,乙池中碳作阳极,铁作阴极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
解答:解:A.甲烧杯中盛有NaCl溶液,则该装置发生吸氧腐蚀,石墨棒上氧气得电子发生还原反应,则石墨棒上的电极反应式为O2+2H2O+4e-═4OH-,故A正确;
B.乙烧杯中盛有NaCl溶液,阳极上氯离子放电,阴极上氢离子放电,同时还生成氢氧化钠,所以则乙中的总反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑,故B正确;
2OH-+H2↑+Cl2↑,故B正确;
C.若甲烧杯中盛有CuSO4溶液,铁棒作负极,负极上铁失电子发生氧化反应,则甲中铁棒上的电极反应式为Fe-2e-═Fe2+,故C正确;
D.由2CuSO4+2H2O 2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO,一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,
2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO,一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,
n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,故D错误;
故选D.
点评:本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,难度不大.
解答:解:A.甲烧杯中盛有NaCl溶液,则该装置发生吸氧腐蚀,石墨棒上氧气得电子发生还原反应,则石墨棒上的电极反应式为O2+2H2O+4e-═4OH-,故A正确;
B.乙烧杯中盛有NaCl溶液,阳极上氯离子放电,阴极上氢离子放电,同时还生成氢氧化钠,所以则乙中的总反应为2Cl-+2H2O
 2OH-+H2↑+Cl2↑,故B正确;
2OH-+H2↑+Cl2↑,故B正确;C.若甲烧杯中盛有CuSO4溶液,铁棒作负极,负极上铁失电子发生氧化反应,则甲中铁棒上的电极反应式为Fe-2e-═Fe2+,故C正确;
D.由2CuSO4+2H2O
 2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO,一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,
2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO,一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,故D错误;
故选D.
点评:本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,难度不大.

练习册系列答案
相关题目
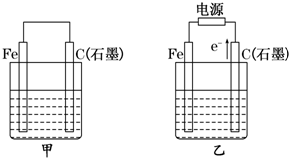 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.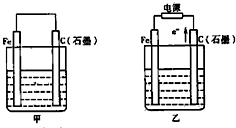 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.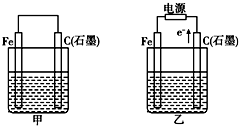 如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )
如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )