题目内容
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要____(填“放出”或“吸收”)___kJ的热量。
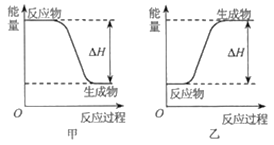
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图____(填“甲”或“乙”)。
(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的H___(填“相等”或“不相等”)。
【答案】放出 92.25 甲 相等
【解析】
(1)根据反应热等于断裂反应物化学键吸收的能量与形成生成物化学键释放的能量差计算;
(2)根据放热反应的反应物的能量高于生成物,吸热反应的反应物能量低于生成物判断;
(3)根据反应热只与物质的始末状态有关,与反应途径、条件无关分析。
(1)由H2和Cl2反应生成1molHCl,则需断裂0.5molH-H和0.5molCl-Cl键,吸收的能量为:0.5×436.4kJ+0.5×242.7kJ=339.55kJ,生成1molHCl放出的能量为431.8kJ,339.55kJ<431.8kJ,所以发生该反应放出热量,放出的能量Q=431.8kJ-339.55kJ=92.25kJ;
(2)H2可以在Cl2中燃烧反应是放热反应,在甲、乙两图中,甲图中反应物的能量高于生成物,表示的是放热反应,乙图中反应物的能量低于生成物,表示的是吸热反应,所以表示该反应能量变化的是图甲;
(3)化学反应的反应热与反应过程无关,只与反应的始态和终态有关,所以无论是H2与Cl2在光照条件下会发生爆炸还是在同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的燃烧反应,反应热H相等。