题目内容
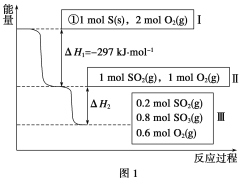
【题目】(1)利用N2和H2可以实现NH3的工业和成,而氨又可以进一步制备硝酸。已知:
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
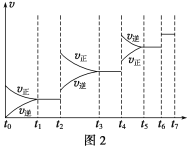
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):

图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
a、b、c三点中,N2转化率最高的是 (填字母)。
若容器容积为1L,T2℃在起始体系中加入1molN2,n(H2)=3mol,经过5min反应达到平衡时H2的转化率为60%,则v(NH3)= 。
【答案】(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.0kJ/mol(3分)
(2)①低于 ②c ③0.24mol/(L·min)(3分)
【解析】
试题分析:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2生成物氨气的量增加,平衡正移,故T2<T1;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为c;
③化学平衡三行计算列式计算,
N2(g)+3H2(g)2NH3(g)
起始量(mol)1 3 0
变化量(mol)0.6 3×60% 1.2
平衡量(mol) 0.4 1.2 1.2
反应速率v=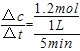 =0.24mol/(L.min)。
=0.24mol/(L.min)。

【题目】用下图所示装置检验乙烯时不需要除杂的是( )

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | Br2的CCl4溶液 |