题目内容
下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(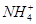 )、c(H+)均减小 )、c(H+)均减小 |
B.常温下,c(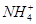 )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |
| D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=2∶9 |
B
常温下,在稀溶液中c(H+)与c(OH-)的乘积是个定值,稀释0.1 mol·L-1的氨水,c(OH-)、c(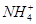 )减小,c(H+)增大,A项错误;Fe2+的水解抑制
)减小,c(H+)增大,A项错误;Fe2+的水解抑制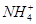 的水解,
的水解, 的水解促进
的水解促进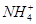 的水解,所以等浓度的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3的溶液的c(NH):②>①>④>③,因此,c(
的水解,所以等浓度的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3的溶液的c(NH):②>①>④>③,因此,c(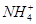 )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③,B项正确;根据越弱越水解的规律可知浓度相同的CH3COONa、NaHCO3和Na2CO3三种溶液的pH为:Na2CO3>NaHCO3>CH3COONa,因此,pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),C项错误;pH=11的NaOH溶液的c(OH-)=10-2mol/L,pH=1的稀硫酸的c(H+)=10-1mol/L,混合液的pH=2,则有
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③,B项正确;根据越弱越水解的规律可知浓度相同的CH3COONa、NaHCO3和Na2CO3三种溶液的pH为:Na2CO3>NaHCO3>CH3COONa,因此,pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),C项错误;pH=11的NaOH溶液的c(OH-)=10-2mol/L,pH=1的稀硫酸的c(H+)=10-1mol/L,混合液的pH=2,则有 ,得a∶b=9∶2,D项错误。
,得a∶b=9∶2,D项错误。
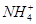 )减小,c(H+)增大,A项错误;Fe2+的水解抑制
)减小,c(H+)增大,A项错误;Fe2+的水解抑制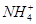 的水解,
的水解, 的水解促进
的水解促进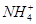 的水解,所以等浓度的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3的溶液的c(NH):②>①>④>③,因此,c(
的水解,所以等浓度的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3的溶液的c(NH):②>①>④>③,因此,c(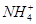 )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③,B项正确;根据越弱越水解的规律可知浓度相同的CH3COONa、NaHCO3和Na2CO3三种溶液的pH为:Na2CO3>NaHCO3>CH3COONa,因此,pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),C项错误;pH=11的NaOH溶液的c(OH-)=10-2mol/L,pH=1的稀硫酸的c(H+)=10-1mol/L,混合液的pH=2,则有
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③,B项正确;根据越弱越水解的规律可知浓度相同的CH3COONa、NaHCO3和Na2CO3三种溶液的pH为:Na2CO3>NaHCO3>CH3COONa,因此,pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),C项错误;pH=11的NaOH溶液的c(OH-)=10-2mol/L,pH=1的稀硫酸的c(H+)=10-1mol/L,混合液的pH=2,则有 ,得a∶b=9∶2,D项错误。
,得a∶b=9∶2,D项错误。
练习册系列答案
相关题目
 、
、
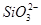 、
、 、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是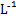 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]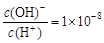 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1
, 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1