题目内容
8.将75mL由甲烷、氢气、一氧化碳组成的混合气与200mL氧气混合点燃,经充分反应并干燥后,总体积减小了100mL,再将剩余的气体通入碱石灰吸收,体积又减小了50mL,上述体积均在25℃,1.01×105Pa下测定,求原混合气体中各组分的体积.分析 充分燃烧发生反应:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,将燃烧后剩余气体通过碱石灰吸收,体积又减少50mL为CO2的体积,最终剩余气体为氧气,设甲烷、氢气、一氧化碳的体积分别为x mL、y mL和zmL,根据体积差量法表示出各自燃烧体积减少量、生成二氧化碳的体积,根据燃烧体积减少量、总体积及二氧化碳的体积列方程计算.
解答 解:根据反应CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2可知,氧气是过量的,
经充分反应并干燥后,总体积减小了100mL,再将剩余的气体通入碱石灰吸收,体积又减小了50mL,则减少的50mL为二氧化碳,
设甲烷、氢气、一氧化碳的体积分别为x mL、y mL和zmL,则:
CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 体积减少△V
1 2 1 2
xmL 2x xmL 2xmL
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O 体积减少△V
2 1 3
ymL 0.5ymL 1.5y mL
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 体积减少△V
2 1 2 1
zmL 0.5zmL zmL 0.5zmL
则:根据总体积可得:①x+y+z=75,
根据气体体积减少可得:②2x+1.5y+0.5z=100,
根据生成二氧化碳体积可得:③x+z=50,
联立①②③解得:x=y=z=25,
答:原混合气体中甲烷、氢气和一氧化碳体积都是25mL.
点评 本题考查混合物反应的计算,题目难度中等,明确发生的反应实质是解题关键,注意差量法在化学计算中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | Ba2+、Na+、I-、ClO- | B. | Mg2+、Cl-、CH3COO-、CO32- | ||
| C. | K+、Cl-、Fe2+、NO3- | D. | Ca2+、Cl-、Na+、Br- |

| A. | 用图1装置制取乙酸乙酯 | |
| B. | 用图2装置制取、收集乙炔气体 | |
| C. | 用图3检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 用图4检验C2H5OH 与浓H2SO4加热至170℃制取乙烯 |
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛浓硫酸的洗气瓶 | |
| C. | 除去乙炔中混有水蒸气,通过盛碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
| A. | 充电时,阴极反应式:LiCo2-xe-═Li1-xCoO2+xLi+ | |
| B. | 充电时,阳极反应式:6C+xLi++xe-═LixC6 | |
| C. | 充电时,电池的负极与电源的负极相连 | |
| D. | 放电时,Li+向负极移动 |
| A. | 向浓度均为0.1 mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) | |
| B. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| C. | 用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 | |
| D. | 用铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O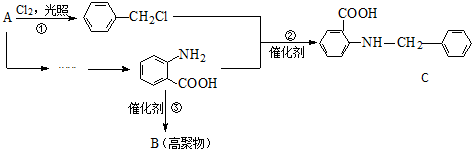
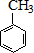 $→_{水浴加热}^{浓H_{2}SO_{4}/浓HNO_{3}}$
$→_{水浴加热}^{浓H_{2}SO_{4}/浓HNO_{3}}$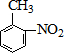
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$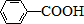
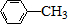
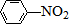 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$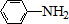 (弱碱性,易被氧化)
(弱碱性,易被氧化) .
.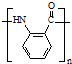 .
.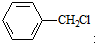 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.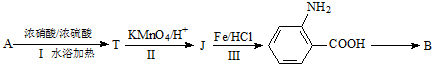
 .
.