题目内容
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214 kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式 .
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.其负极电极反应式是 .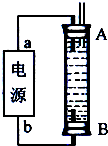
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是 (填序号).
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为 (填“吸”或“放”)热反应.
②实验1中,以v(H2)表示的平均反应速率为 .
③实验2中,达到平衡时CO的转化率为 .
④实验3跟实验2相比,改变的条件可能是 (答一种情况即可).
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含溶质为: .
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214 kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.其负极电极反应式是

②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为
③实验2中,达到平衡时CO的转化率为
④实验3跟实验2相比,改变的条件可能是
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含溶质为:
分析:(1)依据热化学方程式和盖斯定律计算得到热化学方程式,燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量;
(2)①甲烷燃料电池的电解质溶液是碱溶液,原电池反应燃料在负极发生氧化反应,依据电荷守恒书写电极反应;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B.阳极上铁失电子得到亚铁离子,阴极上氢离子放电,所以可以电解质溶液可以选取氯化钠溶液;
C.阳极应该用铁电极,阴极用惰性电极亦可;
D.阴极上得电子生成氢气;
(3)①第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;
②根据方程式可知v(H2)=v(CO2),根据v=
计算;
③依据平衡时二氧化碳物质的量计算消耗的一氧化碳物质的量,结合转化率概念计算得到;
④实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态一样;
(4)依据二氧化碳和氢氧化钠物质的量之比,利用极值方法计算判断生成产物.
(2)①甲烷燃料电池的电解质溶液是碱溶液,原电池反应燃料在负极发生氧化反应,依据电荷守恒书写电极反应;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B.阳极上铁失电子得到亚铁离子,阴极上氢离子放电,所以可以电解质溶液可以选取氯化钠溶液;
C.阳极应该用铁电极,阴极用惰性电极亦可;
D.阴极上得电子生成氢气;
(3)①第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;
②根据方程式可知v(H2)=v(CO2),根据v=
| △c |
| △t |
③依据平衡时二氧化碳物质的量计算消耗的一氧化碳物质的量,结合转化率概念计算得到;
④实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态一样;
(4)依据二氧化碳和氢氧化钠物质的量之比,利用极值方法计算判断生成产物.
解答:解:(1)①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214 kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566 kJ/mol;
由据盖斯定律①+②得到 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-1780kJ?mol-1;
燃烧热为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1;
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,燃料在负极上失电子发生氧化反应,电极反应为:CH4-8e-+10 OH-═CO32-+7H2O,
故答案为:CH4-8e-+10 OH-═CO32-+7H2O;
②A、因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,故A错误;
B、因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上水得电子生成氢气和氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以电极反应式为:2H2O+2e-═H2↑+2OH-,故D正确;
故选:BD;
(3)①实验1中CO的转化率为
×100%=40%,实验2中CO的转化率为
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放;
②根据方程式可知v(H2)=v(CO2),则v(H2)=v(CO2)=
=0.16mol/(L?min),
故答案为:0.16mol/(L?min);
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态一样,应是使用了催化剂,由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,
故答案为:使用了催化剂或增大了压强;
(4)将2.4g碳物质的量=
=0.2mol,在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,氢氧化钠物质的量=0.1mol×3.0mol/L=0.3mol;n(CO2):n(NaOH)=0.2:0.3=2:3,
完全吸收后,若二氧化碳和氢氧化钠反应生成碳酸钠,CO2+2NaOH═Na2CO3+H2O,物质的量之比n(CO2):n(NaOH)=1:2,
若二氧化碳和氢氧化钠反应生成碳酸氢钠,物质的量之比n(CO2):n(NaOH)=1:1,
而1:2<2:3<1:1,所以生成的产物为碳酸钠和碳酸氢钠,
故答案为:NaHCO3、Na2CO3.
②2CO(g)+O2(g)═2CO2(g)△H2=-566 kJ/mol;
由据盖斯定律①+②得到 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-1780kJ?mol-1;
燃烧热为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1;
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,燃料在负极上失电子发生氧化反应,电极反应为:CH4-8e-+10 OH-═CO32-+7H2O,
故答案为:CH4-8e-+10 OH-═CO32-+7H2O;
②A、因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,故A错误;
B、因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上水得电子生成氢气和氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以电极反应式为:2H2O+2e-═H2↑+2OH-,故D正确;
故选:BD;
(3)①实验1中CO的转化率为
| 1.6mol |
| 4mol |
| 0.4mol |
| 2mol |
故答案为:放;
②根据方程式可知v(H2)=v(CO2),则v(H2)=v(CO2)=
| ||
| 5min |
故答案为:0.16mol/(L?min);
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态一样,应是使用了催化剂,由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,
故答案为:使用了催化剂或增大了压强;
(4)将2.4g碳物质的量=
| 2.4g |
| 12g/mol |
完全吸收后,若二氧化碳和氢氧化钠反应生成碳酸钠,CO2+2NaOH═Na2CO3+H2O,物质的量之比n(CO2):n(NaOH)=1:2,
若二氧化碳和氢氧化钠反应生成碳酸氢钠,物质的量之比n(CO2):n(NaOH)=1:1,
而1:2<2:3<1:1,所以生成的产物为碳酸钠和碳酸氢钠,
故答案为:NaHCO3、Na2CO3.
点评:本题考查化学平衡的计算,化学反应产物判断方法,题目难度中等,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
O2(g)=CO2(g)△H2=-283kJ?mol-1
H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;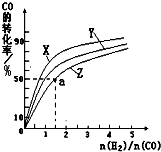
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K= .
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
请完成并配平上述化学方程式.其中氧化剂是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为

②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
 (2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.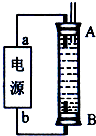 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.