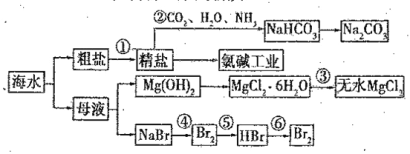
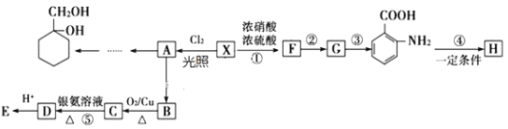
题目内容
【题目】Ⅰ.2A![]() B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是________反应(填“放热”或“吸热”);
(2)若B为固体,减小压强平衡向逆反应方向移动,则A呈______态;
(3)若A、B、C均为气体,加入催化剂,平衡______移动(填“正向”、“逆向”或“不”)
Ⅱ.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
(1)用D表示的平均反应速率为____________,A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度____________(填“增大”、“减少”或“不变”)。
(3)若向原平衡体系再投入1 molA和1 mol B,平衡____________(填“右移、左移或不移”)。
Ⅲ.氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol。
2NH3(g);ΔH=-92.4 kJ/mol。
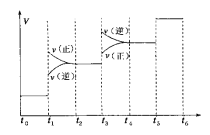
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是____________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
【答案】吸热 气 不 0.2mol/(L·min) 60% 增大 右移 增大压强 t2-t3 ![]()
【解析】
Ⅰ、(1)温度升高,平衡向吸热反应方向移动;
(2)降低压强平衡向气体体积增大的方向移动,据此判断;
(3)使用催化剂,缩短到达平衡的时间,平衡不移动;
Ⅱ、(1)根据v=![]() 计算D的生成速率,根据反应方程式计算A消耗的量,据此计算A的平衡转化率;
计算D的生成速率,根据反应方程式计算A消耗的量,据此计算A的平衡转化率;
(2)混合气体的密度为ρ=![]() ,反应前后气体质量守恒,m不变,据此分析;
,反应前后气体质量守恒,m不变,据此分析;
(3)根据反应物浓度增加,对平衡的影响分析;
III、①根据图象分析影响平衡的因素,主要是反应进行方向和速率的变化特征分析;
②化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,结合三段式进行计算。
Ⅰ、(1)温度升高,平衡向正反应方向移动,由于温度升高,平衡向吸热反应方向移动,故正反应为吸热反应;
(2)B为固体,降低压强平衡向逆反应方向移动,由于降低压强平衡向气体体积增大的方向移动,故逆反应为气体体积增大的反应,故A为气态;
(3)使用催化剂,缩短到达平衡的时间,不影响平衡移动;
Ⅱ、一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,则
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,则
3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始(mol) 2 2 0 0
转化(mol) 1.2 0.4 0.8 0.8
平衡(mol) 0.8 1.6 0.8 0.8
(1)用D表示的平均反应速率为v=![]() =
= =0.2mol/(L·min);A的转化率为α=
=0.2mol/(L·min);A的转化率为α=![]() =60%;
=60%;
(2)混合气体的密度为ρ=![]() ,反应前后气体质量守恒,m不变,缩小容器体积,则V变小,混合气体的密度增大;
,反应前后气体质量守恒,m不变,缩小容器体积,则V变小,混合气体的密度增大;
(3)增加反应物浓度,平衡会正向移动,即向右移动;
Ⅲ、N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
2NH3(g)△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
①由反应速率与时间的关系图象可知,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的,即表示平衡混合物中NH3的含量最高的一段时间是t2~t3;
② N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol/L) 2a 4a 0
反应(mol/L) a 3a 2a
平衡(mol/L
所以化学平衡常数K=![]() =
=![]() 。
。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案