题目内容
16.足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与2.24LO2(标准状况)混合后通入水中,气体被水完全吸收.若向原所得溶液中加入l0mol•L-1H2SO4溶液100mL,则继续溶解的Cu的质量为( )| A. | 0 | B. | 32g | C. | 38.4g | D. | 48g |
分析 Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与2.24LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子守恒得到硝酸铜的物质的量,再根据离子方程式计算加入稀硫酸后溶解的Cu.
解答 解:Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与2.24LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成NO3-得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)=$\frac{\frac{22.4L}{22.4L/mol}×4}{2}$=0.2mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.2mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×10mol/L×0.1L=2mol,n(H+):n(NO3- )=2mol:0.4mol=5:1>$\frac{1}{4}$,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,
设溶解Cu的质量为x,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.4mol
192g:2mol=x:0.4mol
x=$\frac{192g}{2mol}×0.4mol$=38.4g,
故选C.
点评 本题考查氧化还原反应有关计算,为高频考点,明确物质之间反应实质是解本题关键,注意过量计算,注意转移电子守恒的灵活运用,题目难度中等.

练习册系列答案
相关题目
7.实验室欲配制若干体积的1.0mol/L Na2CO3溶液,正确的方法是(假设其余各步操作正确无误)( )
| A. | 将10.6g Na2CO3溶于100mL水中 | |
| B. | 将57.2g Na2CO3•10H2O溶于少量水中,再用水稀释至200mL | |
| C. | 将20 mL 5.0mol/L Na2CO3溶液用水稀释至100mL | |
| D. | 将21.2gNa2CO3•10H2O溶于200mL水中 |
4.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是锂 ②氧化性最强的是锂离子 ③在自然界中均以化合态形式存在 ④Li的密度最大 ⑤铯与水反应十分剧烈,甚至会发生爆炸 ⑥粒子半径:Rb+>K+>Na+,Cs>Cs+.
①金属性最强的是锂 ②氧化性最强的是锂离子 ③在自然界中均以化合态形式存在 ④Li的密度最大 ⑤铯与水反应十分剧烈,甚至会发生爆炸 ⑥粒子半径:Rb+>K+>Na+,Cs>Cs+.
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤⑥ |
11.下列化合物中所有化学键都是共价键的是( )
| A. | Na2O2 | B. | NaOH | C. | BaCl2 | D. | H2SO4 |
5.化学与日常生活密切相关,下列说法错误的是( )
| A. | 84消毒液的有效成分是NaClO | |
| B. | 装饰材料释放的甲醛会造成污染 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 福尔马林可作食品的保鲜剂 |
6.已知2Al+2NaOH+2H2O=2NaAlO2+3H2↑.该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
| A. | 每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2NA | |
| B. | 每生成0.15 molH2,被还原的水分子数目为0.3NA | |
| C. | 当加入2.7gAl时,转移的电子数目为0.3NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
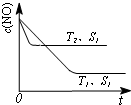 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: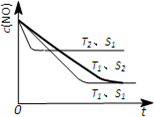 .
.