题目内容
【题目】草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX[X表示c(HC2O4-)/c(H2C2O4)或c(C2O42-)/c(HC2O4-)]随pH的变化关系如图所示。下列说法不正确的是

A. 直线I中X表示的是c(HC2O4-)/c(H2C2O4)
B. 直线I、Ⅱ的斜率均为1
C. 0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 已知:碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,则向Na2CO3溶液中加入等物质的量的草酸溶液的离子方程式为CO32-+H2C2O4===C2O42-+H2O+CO2↑
【答案】C
【解析】
二元弱酸的电离平衡常数![]() ,直线I表示的X与c(H+)的乘积等于1×10-1.22,则H2C2O4的Ka1=1×10-1.22;直线Ⅱ表示X与c(H+)的乘积等于1×10-4.19,则H2C2O4的Ka2=1×10-4.19。
,直线I表示的X与c(H+)的乘积等于1×10-1.22,则H2C2O4的Ka1=1×10-1.22;直线Ⅱ表示X与c(H+)的乘积等于1×10-4.19,则H2C2O4的Ka2=1×10-4.19。
A. 直线I表示的X与c(H+)的乘积等于1×10-1.22,所以直线I中X表示的是c(HC2O4-)/c(H2C2O4),故A正确;
B、直线I表示的X与c(H+)的乘积等于1×10-1.22,lgx=pH-1.22;直线Ⅱ表示X与c(H+)的乘积等于1×10-4.19,lgx=pH-4.19,所以直线I、Ⅱ的斜率均为1,故B正确;
C、HC2O4-的电离平衡常数=1×10-4.19,HC2O4-的水解平衡常数=![]() ,电离大于水解,溶液显酸性,所以0.1mol/ L NaHO2O4溶液中:c(Na+)>c(HC2O4-) >c(C2O42-) >c(H2C2O4),故C错误;
,电离大于水解,溶液显酸性,所以0.1mol/ L NaHO2O4溶液中:c(Na+)>c(HC2O4-) >c(C2O42-) >c(H2C2O4),故C错误;
D、H2C2O4的Ka2大于碳酸的Ka1,所以向Na2CO3溶液中加入等物质的量的草酸溶液,生成草酸钠和二氧化碳,离子方程式为CO32-+H2C2O4===C2O42-+H2O+CO2↑,故D正确;选C。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
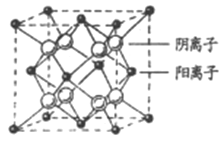
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
【题目】下列对实验事实的解释错误的是
选项 | 实验事实 | 解释 |
A | 用容量瓶配制一定浓度的溶液,定容时仰视读数使所配溶液浓度偏低 | 溶液凹液面最低处高于刻度线 |
B | 用标准硝酸银溶液滴定溶液中氯离子时,标准液盛放在棕色滴定管中 | 硝酸银见光分解 |
C | 向10mL 0.5mol/L的氯化镁溶液中滴加5mL 2.4mol/L氢氧化钠溶液,产生白色沉淀再滴加氯化铜溶液,沉淀变蓝 | Ksp[Cu(OH)2 ]<Ksp[Mg(OH)2 ] |
D | 长时间存放的漂白粉的试剂瓶可用稀盐酸清洗 | 漂白粉在空气中转化为碳酸钙能溶于盐酸 |
A. AB. BC. CD. D
