题目内容
3.水是人类赖以生存的物质,H2O的摩尔质量为( )| A. | 16g/mol | B. | 18g | C. | 20g/mol | D. | 18g/mol |
分析 利用原子的相对原子质量的加和计算相对分子质量,摩尔质量是以g/mol为单位,数值上等于其相对分子质量,以此来解答.
解答 解:H的相对原子质量为1,O的相对原子质量为16,则H2O的相对分子质量为1×2+16=18,摩尔质量为18g/mol,
故选D.
点评 本题考查摩尔质量概念分析,为基础性习题,把握摩尔质量和其相对分子质量的关系为解答的关键,题目较简单.

练习册系列答案
相关题目
11.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
8.只用滴管、试管和水就能鉴别的物质组是( )
| A. | 苯、乙酸、CCl4 | B. | 乙醇、乙酸乙酯、乙酸 | ||
| C. | 苯、硝基苯、溴苯 | D. | 乙醇、甘油、硝基苯 |
15.某原电池的总反应离子方程式为:2Fe3+十Fe═3Fe2+,能实现该反应的原电池是( )
| 正 极 | 负 极 | 电解质溶液 | |
| A | Cu | Fe | FeCl3 |
| B | C | Fe | Fe(NO3)3 |
| C | Fe | Zn | Fe2(SO4)3 |
| D | Ag | Fe | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
12.某高分子化合物的部分结构如图所示,下列说法不正确的是( )

| A. | 聚合物的链节是(如图2) | |
| B. | 聚合物的分子式是(C3H3Cl3)n | |
| C. | 聚合物的单体是CHCl=CHCl | |
| D. | 若n为聚合度,则其相对分子质量为97n |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1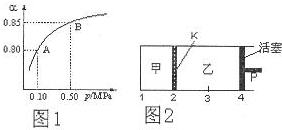 (3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
 (1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;