题目内容
6.现有CuO和Fe2O3的混合物m克,向其中加入1mol•L-1的HNO3溶液200mL恰好完全反应,若将2m克该混合物用足量CO还原,充分反应后剩余固体质量为( )| A. | (2m-1.6)克 | B. | 2(m-1.6)克 | C. | (m-1.6)克 | D. | 3.2克 |
分析 CuO和Fe2O3的混合物与硝酸反应生成硝酸盐和水,CuO~Cu(NO3)2,Fe2O3~Fe(NO3)3,由电荷守恒可知:2n混合物(O)=n(NO3-),据此计算2mg混合物中氧元素的质量,用足量CO还原2m g混合物,反应剩余固体为Cu、Fe,金属氧化物的质量减去氧的质量即为金属的质量.
解答 解:CuO和Fe2O3的混合物与硝酸反应生成硝酸盐和水,CuO~Cu(NO3)2,Fe2O3~Fe(NO3)3,
由电荷守恒可知mg混合物中2n混合物(O)=n(NO3-)=0.2 L×1 mol/L,则n混合物(O)=0.1mol,
故2mg混合物中氧元素的质量为:0.1mol×2×16g/mol=3.2g,
用足量CO还原2m g混合物,反应剩余固体为Cu、Fe,则金属质量为氧化物的质量减去氧的质量,即金属质量为:2mg-3.2g=2(m-1.6)g,
故选B.
点评 本题考查混合物的计算,题目难度中等,确定金属氧化物中O氧原子物质的量与硝酸的物质的量关系是解答该题的关键,也可以根据酸与氧化物生成水计算氧元素质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.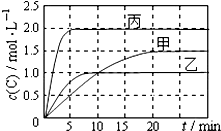 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 10min内乙容器中反应的平均速率:v(A)=0.05mol•(L•min)-1 | |
| B. | 由图可知T1>T2,且该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂 |
14.下列叙述不正确的是( )
| A. | 天然蛋白质水解的最终产物均为氨基酸 | |
| B. | 油脂水解得到的醇是丙三醇 | |
| C. | 淀粉、纤维素水解的产物都是葡萄糖 | |
| D. | 淀粉、纤维素、蛋白质和油脂都属于高分子化合物 |
1.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
11.含H-的化合物跟氨反应:H-+NH3═NH${\;}_{2}^{-}$+H2.根据该反应事实,可以得出的正确结论是( )
| A. | NH3具有还原性 | B. | 含H-的化合物是强氧化剂 | ||
| C. | H2既是氧化产物又是还原产物 | D. | 该反应属于置换反应 |
15.某烃1mol最多能和2mol HCl加成,生成氯代烃,此氯代烃l mol能和4mol Cl2发生完全取代反应,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
16.下列过程是吸收热量的是( )
| A. | 金属钠与水反应 | B. | 碳酸钙高温分解 | C. | 浓硫酸稀释 | D. | 氨气液化 |