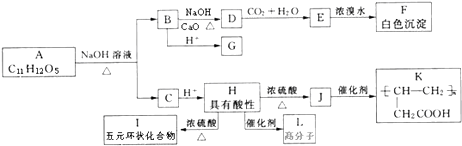
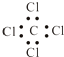��Ŀ����
����Ŀ��ij��ɫ��Һ��ֻ���ܺ���NH4+��K+��Al3+��Fe3+��Cl����SO42���������еļ��֣��ְ����в������ʵ�飺 �ٸ���Һ����ɫ��Ӧ���ֳ���ɫ��
��ȡ10mL����Һ���Թ��еμ�Ba��NO3��2��Һ����ϡ�����ữ����˵õ�0.03mol��ɫ����������Һ�м���AgNO3��Һδ�����������
����ȡ10mL����Һ���Թ��У��μ�NaOH��Һ������ɫ���������������ӵ�һ������ʼ�������壬��������ȫ�ܽ⣬������NaOH��Һ�ļ��룬����������ı仯��ϵ��ͼ��ʾ��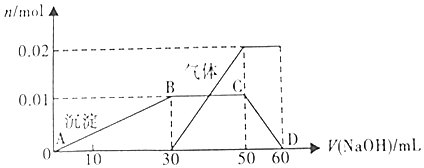
��1������Һ��һ�����е������� �� һ�������е������� ��
��2��������з�����Ӧ�����ӷ���ʽΪ ��
��3��ͼ��CD�η�����Ӧ�����ӷ���ʽΪ ��
��4������ͼ����ʾ���ݣ�����ʵ����ʹ��NaOH��Һ�����ʵ���Ũ��Ϊmol/L����ɫ��Ӧ������ɫ�����ӵ����ʵ���Ũ��Ϊmol/L��
���𰸡�
��1��K+��NH4+��Al3+��SO42���� Cl����Fe3+
��2��SO42��+Ba2+=BaSO4��
��3��Al��OH��3+OH��=AlO2��+2H2O
��4��1��1
���������⣺����Һ����ɫ�ܲ�����ɫ��Ӧ����ɫ��˵����Һ�к���K+���ӣ���Һ����ɫ����һ������Fe3+���ӣ�
��ȡ10mL����Һ���Թ��еμ�Ba��NO3��2��Һ����ϡ�����ữ����˵õ�0.03mol��ɫ����������SO42��+Ba2+=BaSO4��֪��Һ�к���SO42��Ϊ0.03mol������Һ�м���AgNO3��Һδ����������������Һ��û��Cl����
����ȡ10mL����Һ���Թ��У��μ�NaOH��Һ������ɫ��������˵����Һ�к���Al3+����1���ɢ٢ڢ۵ø���Һ��һ�����е�������K+��NH4+��Al3+��SO42����һ�������е�������Cl����Fe3+��
���Դ��ǣ�K+��NH4+��Al3+��SO42����Cl����Fe3+����2�������Ӻ���������ӷ�Ӧ���ɰ�ɫ�������ᱵ������ϡ���ᣬ�����ӷ���ʽΪSO42��+Ba2+=BaSO4����
���Դ��ǣ�SO42��+Ba2+=BaSO4������3�������������������Ʒ�Ӧ����ƫ�����ƺ�ˮ�����������ᣬ���ˮ��������Ȳ��𣬹����ӷ���ʽΪAl��OH��3+OH��=AlO2��+2H2O��
���Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O����4��Al3++3OH��=Al��OH��3�������ͼ���г����ı仯��ϵ��֪��Һ�к���Al3+Ϊ0.01mol��OH��Ϊ0.03mol�����������ӵ�һ������ʼ�������壬����NH4++OH��=NH3��+H2O���ͼ��֪��Һ�к���NH4+Ϊ0.02mol��OH��Ϊ0.02mol����������ȫ�ܽ�����������������NaOH������Ӧ����Ӧ�����ӷ���ʽΪAl��OH��3+OH��=AlO2��+2H2O�����ͼ���г����ı仯��ϵ����OH��Ϊ0.01mol��ʵ����ʹ�õ�NaOH��Һ�������ʵ���Ϊ��0.03mol+0.02mol+0.01mol=0.06mol�����ͼ���г����ı仯��ϵ֪��ʱ����������Һ�����Ϊ60mL������C= ![]() =
= ![]() =1mol/L��
=1mol/L��
����ͼʾ��Ϣ��������Һ����ɫ��Ӧ������ɫ������ΪK+������Һ��һ������K+��NH4+��Al3+��SO42�������ݣ�1����֪NH4+Ϊ0.02mol��Al3+Ϊ0.01mol��SO42��Ϊ0.03mol��������Һ�ʵ�������Һ�����������������������������ȣ��������������Ϊ��0.02mol��1+0.01mol��3+n��K+����1=0.05mol+n��K+�������������0.03mol��2=0.06mol������n��K+��=0.01mol������C= ![]() =
= ![]() =lmol/L��
=lmol/L��
���Դ��ǣ�1��1��

 �����ܿ����ϵ�д�
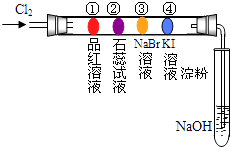
�����ܿ����ϵ�д�����Ŀ��ijͬѧ�������ʵ��װ�ý���±�ص�����ʵ�飮��������װ�зֱ���в�ͬ��Һ������Ӧһ��ʱ���ͼ��ָ����λ��ɫ������ȷ���ǣ�������
�� | �� | �� | �� | |
A | ��ɫ | �ȱ��ɫ����ɫ | ��ɫ | ��ɫ |
B | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
C | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
D | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
A.A
B.B
C.C
D.D