题目内容
1.在下列各溶液中,离子一定能大量共存的是( )| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42- | |
| C. | 含有Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 水电离产生的c(H+)=1×10-13 mol/L的溶液中:Na+、K+、Cl-、SO42- |
分析 A.与OH-反应的离子不能大量共存;
B.酸性条件下NO3-具有强氧化性;
C.与Ca2+反应的离子不能大量共存;
D.水电离产生的c(H+)=1×10-13 mol/L的溶液,可能呈酸性或碱性.
解答 解:A.Al3+与OH-反应而不能大量共存,故A错误;
B.酸性条件下NO3-具有强氧化性,Fe2+不能大量共存,故B错误;
C.CO32-与Ca2+反应而不能大量共存,故C错误;
D.水电离产生的c(H+)=1×10-13 mol/L的溶液,可能呈酸性或碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目
13.下面实验操作不能实现实验目的是( )
| A. | 鸡蛋白溶液中,加入浓的硫酸铵溶液有沉淀析出,加入水后沉淀溶解 | |
| B. | 用银氨溶液可以鉴别葡萄糖和果糖溶液. | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 取少量淀粉溶液,加入一定量稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热,观察现象,判断淀粉的水解的产物中是否含有葡萄糖 |
12.下列有关有机物分离、提纯或除杂的方法错误的是( )
| A. | 溴苯中混有溴:加NaOH溶液洗涤、静置、分液 | |
| B. | 除去乙醇中少量乙酸:加入足量生石灰蒸馏 | |
| C. | 乙烯中混有SO2:将其通过盛有酸性KMnO4溶液的洗气瓶,再干燥 | |
| D. | 乙酸乙酯中有乙酸杂质:加入饱和Na2CO3溶液,充分反应后静置分液 |
9.下列反应一定属于吸热反应的是( )
| A. | 酸碱中和反应 | |
| B. | 不需要加热就能发生的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应 |
16.下列有关说法正确的是( )
| A. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| B. | 明矾溶于水可以使水净化,是因为明矾中的Al3+水解显酸性 | |
| C. | 己知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大 | |
| D. | NH3(g)+HCl(g)=NH4Cl(s)是熵减小的反应,较低温度下能自发进行,说明该反应的△H>0 |
6.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )


| A. | 若此反应过程中有电子转移,可设计成原电池 | |
| B. | 该反应为放热反应 | |
| C. | 该反应在常温下也有可能进行 | |
| D. | 反应物的总能量高于生成物的总能量 |
化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 | |
A | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
|
B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 | |
C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 | |
D | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 | |
11.下列关于有机化合物的说法正确的是( )
| A. | 氯乙烯和聚乙烯均能发生加成反应 | |
| B. |  和 和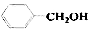 互为同系物 互为同系物 | |
| C. | 用新制氢氧化铜悬浊液能鉴别葡萄糖和乙酸 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
