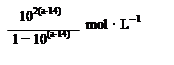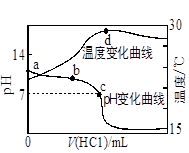题目内容
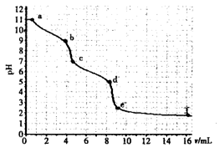
常温下,在l00mL 1mol/L 的NaHCO3溶液中,加入Xmol的Ba(OH)2固体(假设溶液体积和温度保持不变)。以下关于溶液中c(CO32-)及c(HCO3-)的变化判断正确的是
| A.当X=0.025时,溶液中有HCO3-和CO32-,且2C (CO32-) =" C(" HCO3-) |
| B.当X=0.05时,溶液中有HCO3-和CO32-,且C (CO32-)> C( HCO3-) |
| C.当X=0.06时,溶液中HCO3-、CO32-浓度都减小了 |
| D.当X=0.1时,溶液pH增大,沉淀达到最大值 |
BD
试题分析:A、当X=0.025时,溶液中发生反应:NaHCO3(少)+Ba(OH)2═BaCO3↓+NaOH+H2O,NaHCO3过量0.075mol,继续发生反应:NaHCO3+NaOH=Na2CO3+H2O,剩余NaHCO30.05mol,生成Na2CO30.025mol,所以溶液中有HCO3-和CO32-,但CO32-发生水解生成HCO3-,则2c(CO32-)<c(HCO3-),故A错误;B、当X=0.05时,溶液恰好发生反应:2NaHCO3(过)+Ba(OH)2=BaCO3↓+Na2CO3+2H2O,CO32-发生水解生成HCO3-,所以溶液中有HCO3-和CO32-,且c(CO32-)>c(HCO3-),故B正确;C、当X=0.06时,溶液发生反应:NaHCO3(少)+ Ba(OH)2═BaCO3↓+NaOH+H2O,NaHCO3过量0.04mol,继续发生反应:NaHCO3+NaOH=Na2CO3+H2O,剩余NaOH0.02mol,生成Na2CO30.04mol,所以溶液中有HCO3-和CO32-,但CO32-发生水解生成HCO3-,溶液中HCO3-浓度减小,CO32-浓度增大,故C错误;D、当X=0.1时,溶液中恰好发生反应:NaHCO3(少)+ Ba(OH)2=BaCO3↓+NaOH+H2O,溶液碱性增强,溶液pH增大,Ba(OH)2完全沉淀,沉淀达到最大值,故D正确,答案选BD。

练习册系列答案
相关题目