题目内容
3.分子式为C3H7OCl,且分子含有烃基的同分异构体的数目为(不考虑立体异构)( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 C3H7OCl可以可知丙烷中的2个H原子分别被1个Cl、1个-OH取代,丙烷只有一种结构,Cl与-OH可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子,据此书写判断.
解答 解:C3H7OCl可以可知丙烷中的2个H原子分别被1个Cl、1个-OH取代,丙烷只有一种结构,Cl与-OH可以取代同一碳原子上的H原子,有2种:CH3CH2CHOHCl、CH3COHClCH3,可以取代不同碳原子上的H原子,有3种:HOCH2CH2CH2Cl、CH3CHOHCH2Cl、CH3CHClCH2OH,共有5种,故选C.
点评 本题考查同分异构体的书写,难度中等,注意二元取代可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子.

练习册系列答案
相关题目
13.卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
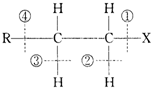

| A. | 该卤代烃发生水解反应时,被破坏的键是①和④ | |
| B. | 该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和② |
11.2005年10月5日瑞典皇家科学院在瑞典首都斯德哥尔摩宣布,法国人伊夫•肖万、美国人罗伯特•格拉布和理查德•施罗克,因在烯烃复分解反应研究方面的贡献而荣获2005年度诺贝尔化学奖.在石油化工中,利用烯烃复分解反应可以将丁烯和乙烯转化为丙烯,方程式如下:CH3CH=CHCH3+CH2=CH2$\stackrel{催化剂}{→}$2CH2=CHCH3从反应类型上看,该反应还可看作( )
| A. | 取代反应 | B. | 加成反应 | C. | 消去反应 | D. | 裂解反应 |
18.有8种物质:①甲烷;②苯;③聚乙烯;④异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
15.下列说法正确的是( )
| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |
12.向NaBr和NaI混合溶液中通入足量氯气后,将溶液蒸干并灼烧,最后得到的物质是( )
| A. | NaBr和NaI | B. | NaCl | C. | NaBr和NaCl | D. | NaCl和 I2 |
13.中小学生使用的涂改液被称为“隐形杀手”,是因为涂改液里主要含有二甲苯 等有机烃类物质,长期接触二甲苯会对血液循环系统产生损害,可导致再生障碍性贫血和骨髓综合症(白血病的前期).下列说法不正确的是( )
| A. | 二甲苯有三种同分异构体 | |
| B. | 二甲苯和甲苯是同系物 | |
| C. | 二甲苯分子中,所有碳原子都在同一个平面上 | |
| D. | 1mol二甲苯完全燃烧后,生成的二氧化碳和水的物质的量相等 |
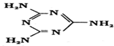 ,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.