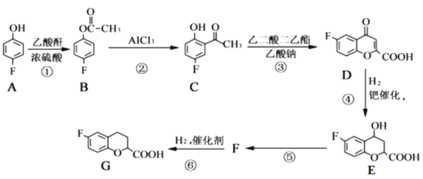
题目内容
【题目】设![]() 表示阿伏加德罗常数的值,下列说法正确的是( )
表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温下![]() 的
的![]() 溶液中
溶液中![]() 与
与![]() 数目均为
数目均为![]()
B.![]() 葡萄糖和果糖的混合物中含羟基数目为
葡萄糖和果糖的混合物中含羟基数目为![]()
C.![]() 与足量
与足量![]() 反应,生成
反应,生成![]() 和
和![]() 的混合物,Na失去
的混合物,Na失去![]() 个电子
个电子
D.室温下,![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
【答案】B
【解析】
A.CH3COONH4溶液中CH3COO-与![]() 均要水解,其数目均小于NA,故A错误;
均要水解,其数目均小于NA,故A错误;
B.葡萄糖为五羟基醛,果糖为五羟基酮,二者互为同分异构体,摩尔质量均为180g/mol,故18g混合物的物质的量为![]() =0.1mol,二者任意比例混合,所含羟基数目都是0.5NA,故B正确;
=0.1mol,二者任意比例混合,所含羟基数目都是0.5NA,故B正确;
C.1mol Na与足量O2反应,无论生成什么产物,Na均变为+1价,故1mol钠均失去NA个电子,故C错误;
D.1L pH=13的NaOH溶液中,氢离子浓度为10-13mol/L,溶液中的氢离子由水电离产生,而水电离出的氢离子浓度和水电离出的氢氧根的浓度相同,因此溶液中水电离的c(OH-)=10-13mol/L,故1L溶液中水电离出的氢氧根的个数为10-13NA个,故D错误;
故选B。

【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。

过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |

①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2