题目内容
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之______________。(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之______________。(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
(1)AlH3 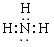
(2)AlH3+3H2O=Al(OH)3+3H2↑
(3)Mg3N2
(4)2NH3+3CuO 3Cu+ N2↑+3H2O;取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。
3Cu+ N2↑+3H2O;取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。
(5)可能;AlH3中含-1价H,NH3中含+1价H,可发生氧化还原反应产生H2。
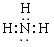
(2)AlH3+3H2O=Al(OH)3+3H2↑
(3)Mg3N2
(4)2NH3+3CuO
 3Cu+ N2↑+3H2O;取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。
3Cu+ N2↑+3H2O;取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。(5)可能;AlH3中含-1价H,NH3中含+1价H,可发生氧化还原反应产生H2。
单质气体丙在标准状态下的密度为1.25 g/L,则丙的相对分子质量为28,故单质丙为N2,化合物乙分解得到H2和N2,化合物乙为NH3。6.00 g化合物甲分解得到短周期元素的金属单质和0.3 molH2,则短周期元素的金属单质的质量为5.4 g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,进而可判定化合物甲为AlH3。第(4)题的实验设计的关键是Cu2O溶解而Cu不溶解:①Cu2O为碱性氧化物;②不能选用具有强氧化性的试剂,否则Cu被氧化为Cu2+,则选用稀硫酸即可。

练习册系列答案
相关题目