题目内容
 I:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们.根据以上信息回答下列有关问题:
I:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们.根据以上信息回答下列有关问题:(1)B2A4、C2A4、E2A4三种化合物的沸点由高到低的顺序为
N2H4>P2H4>C2H4
N2H4>P2H4>C2H4
.(2)由以上元素中若干种组成化合物中,有许多离子化合物,其中由四种元素组成的摩尔质量最小的一种的化学式是
HCOONH4
HCOONH4
.(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是
NH4NO3
NH4NO3
;最新合成的化学式为B1C4D8的物质中同种原子的化学环境完全相同,t它是一种威力极强的炸药,推测它的结构简式是

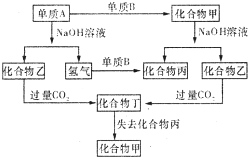
II:由短周期元素组成的以下各单质和化合物之间存在图示转化关系.
(4)若A和甲均不溶于盐酸,则甲与NaOH溶液反应时每1mol甲失去 4mol e-,写出乙转化为丁的离子方程式
SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-
SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-
(5)若A和甲均可溶于盐酸,且A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则该氯化物的化学式为
Al2Cl6
Al2Cl6
,工业生产单质A的化学方程式为2Al2O3
4Al+3O2↑
| ||
| 电解 |
2Al2O3
4Al+3O2↑
.
| ||
| 电解 |
分析:I:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们,则B、A为C元素或H元素,a+b=c,c=1+6=7,即C为N元素;c=7,a+c=d,c+d=e,则a+14=e,若a=1,则e=15,所以A为氢元素,E为磷元素,符合题意;若=6,则e=20,E为钾元素,不是短周期元素,不符合题意.a+c=d,则d=1+7=8,则D为氧元素.所以A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为磷元素.
解答:解:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们,则B、A为C元素或H元素,a+b=c,c=1+6=7,即C为N元素;c=7,a+c=d,c+d=e,则a+14=e,若a=1,则e=15,所以A为氢元素,E为磷元素,符合题意;若=6,则e=20,E为钾元素,不是短周期元素,不符合题意.a+c=d,则d=1+7=8,则D为氧元素.
所以A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为磷元素.
(1)B2A4、C2A4、E2A4三种化合物分别为C2H4、N2H4、P2H4,都为分子晶体,相对分子质量越大,沸点越高,但由于氮元素电负性很强,所以N2H4中存在氢键,沸点相对更高,所以沸点由高到低的顺序为N2H4>P2H4>C2H4.
故答案为:N2H4>P2H4>C2H4.
(2)由以上元素中若干种组成化合物中,有许多离子化合物,离子化合物为铵盐,其中由四种元素组成的摩尔质量最小的一种的化学式是 HCOONH4.
故答案为:HCOONH4.
(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是NH4NO3;最新合成的化学式为B1C4Ds的物质化学式应是CN4O8,CN4O8中同种原子的化学环境完全相同,它是一种威力极强的炸药,其结构为正四面体,C原子位于正四面体中心,四个顶点均连接1个-NO2,它的结构简式是 .
.
故答案为:NH4NO3; .
.
(4)若A和甲均不溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为硅单质,乙为硅酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为二氧化硅,单质B为氧气.则A与NaOH溶液反应时每1molA失去4 mol e-,二氧化碳过量生成碳酸氢根,所以乙转化为丁的离子方程式为SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
故答案为:4;SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
(5)若A和甲均可溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为铝单质,乙为偏铝酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为氧化铝,单质B为氧气.A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则A的氯化物的相对分子质量为32×8.34=267,则该氯化物的化学式为Al2Cl6,工业生产单质Al为电解熔融的氧化铝,化学方程式为 2Al2O3
4Al+3O2↑.
故答案为:Al2Cl6;2Al2O3
4Al+3O2↑.
所以A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为磷元素.
(1)B2A4、C2A4、E2A4三种化合物分别为C2H4、N2H4、P2H4,都为分子晶体,相对分子质量越大,沸点越高,但由于氮元素电负性很强,所以N2H4中存在氢键,沸点相对更高,所以沸点由高到低的顺序为N2H4>P2H4>C2H4.
故答案为:N2H4>P2H4>C2H4.
(2)由以上元素中若干种组成化合物中,有许多离子化合物,离子化合物为铵盐,其中由四种元素组成的摩尔质量最小的一种的化学式是 HCOONH4.
故答案为:HCOONH4.
(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是NH4NO3;最新合成的化学式为B1C4Ds的物质化学式应是CN4O8,CN4O8中同种原子的化学环境完全相同,它是一种威力极强的炸药,其结构为正四面体,C原子位于正四面体中心,四个顶点均连接1个-NO2,它的结构简式是
 .
.故答案为:NH4NO3;
 .
.(4)若A和甲均不溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为硅单质,乙为硅酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为二氧化硅,单质B为氧气.则A与NaOH溶液反应时每1molA失去4 mol e-,二氧化碳过量生成碳酸氢根,所以乙转化为丁的离子方程式为SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
故答案为:4;SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
(5)若A和甲均可溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为铝单质,乙为偏铝酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为氧化铝,单质B为氧气.A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则A的氯化物的相对分子质量为32×8.34=267,则该氯化物的化学式为Al2Cl6,工业生产单质Al为电解熔融的氧化铝,化学方程式为 2Al2O3
| ||
| 电解 |
故答案为:Al2Cl6;2Al2O3
| ||
| 电解 |
点评:考查元素化合物推断、晶体结构、化学用语等,难度较大,推断元素是关键,是对所学知识的综合运用与学生能力考查,注意基础知识的掌握.

练习册系列答案
相关题目
 Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的 NH3?H2O+H+
NH3?H2O+H+