��Ŀ����
�����£���Cl2����ͨ��һ������ˮ�������ͣ�Ȼ�������ñ�����ˮ����μ���0.1mol��L-1������������Һ������������pH�仯��ͼ��ʾ�������й�������ȷ����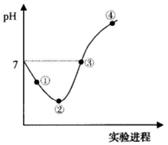
| A���ڵ�֮ǰ��������Ӧ�����ӷ���ʽΪCl2+H2O=2H++Cl��+ClO�� |
| B���۵���ʾ��Һ�У�c(Na+)= c(HClO)+2c(ClO-) |
| C��ʵ���������Һ��pH������pH��ֽ��� |
| D�����ߵ���ʼ��ˮ�ĵ���̶���� |
B
�������������A���ڵ�֮ǰ������Cl2��H2O��Ӧ����HCl��HClO�ķ�Ӧ��HClOΪ���ᣬ���ܲ�����ӣ�����B���۵���Һ�����ԣ���c��H+��=c��OH-�������ݵ���غ��c��H+��+c��Na+��=c��Cl-��+c��Cl0-��+c��OH-��������c��Na+��=c��Cl-��+c��ClO-�������������غ��c��Cl-��=c��ClO-��+c��HClO��������c��Na+��=c��HClO��+2c��ClO-������ȷ��C����Ϊ��ˮ�к���HClO������Ư���ԣ�����ʵ���������Һ��pH������pH��ֽ��ã�����D��Cl2��NaOHǡ�÷�Ӧʱˮ�ĵ���̶������
���㣺���⿼��Cl2�����ʡ�ͼ��ķ�����pH��ֽ��ʹ�á�����Ũ�ȱȽϡ�ˮ�ĵ��롣

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д���ѧ��Seidelָ��Si��NaOH��Һ�ķ�Ӧ��������Si��OH-��Ӧ������SiO44-��Ȼ��SiO44-Ѹ��ˮ������H4 SiO4�������й�˵����ȷ���ǣ� ����
| A��ԭ�����ƣ�Na4SiO4����Ѹ��ˮ�⣬��ˮ���ʼ��ԣ���Na4SiO4Ϊ������� |
| B��ʯӢ��������ͨ�������մɼ�ˮ������ڹ����β�Ʒ |
| C��2HCl +Na2SiO3 = H2SiO3��+2NaCl˵��Cl �ķǽ����Դ���Si |
| D���뵼�幤ҵ��˵�ġ���ɳ̲����ͥ����ָ�������������Ƴɾ���� |
�ؿ��к�����һ�͵ڶ�����Ԫ���γɵĻ���������е������� (����)��
| A����һ�������¿���NaOH��Һ��Ӧ |
| B����̼�ڸ����·�Ӧ����ȡ��Ԫ���е�һ�ֵ��� |
| C���۵�ܸߣ��������ͻ���� |
| D������������ˮ��Ӧ������Ӧ���� |
�����Ƶ���ˮ�м���������̼���Ʒ�ĩ������˵����ȷ����(����)
| A��pH����HClOŨ������ | B��pH��С��Cl��Ũ������ |
| C��pH����Cl��Ũ�ȼ�С | D��pH��С��HClOŨ�ȼ�С |
��ҵ���ɴֹ���ȡ�ߴ��������·�Ӧ����Si(s)��3HCl(g)=SiHCl3(g)��H2(g)����H����381 kJ��mol��1��
��SiHCl3(g)��H2(g)=Si(s)��3HCl(g)����������Ӧ��˵������ȷ����(����)��
| A����Ϊ�û���Ӧ��������ԭ��Ӧ |
| B����Ӧ�١���ʵ���ϻ�Ϊ���淴Ӧ |
| C�����ڷ�Ӧ�ٷ��ȣ���Ӧ�ڿ��������ȵģ�Ҳ�����Ƿ��ȵ� |
| D�����SiHCl3���ʣ�Ӧ���ü�ѹ�����µİ취 |
����˵����ȷ���ǣ� ��
| A����ˮ�к�����ߵ�Ԫ������ |
| B����ˮ�к�����ߵ��������Ȼ��� |
| C���ӵ�ʳ����Һ��������Һ����ɫ |
| D���ӵ�ʳ���еĵ��Ǻ���Ԫ�صĻ����� |
�������裨SiO2���ֳƹ�ʯ�����Ʊ��輰�仯�������Ҫԭ�ϣ������ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
| A��SiO2�������������� |
| B��ʢ��Na2CO3��Һ���Լ�ƿ�����ò����� |
| C���轺��ˮ�����ظ����� |
| D��ͼ����ʾת����Ӧ����������ԭ��Ӧ |
ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵����ȷ���ǣ� ��

| A����ͼ��:���MnO2����,Ũ����Ϳ�ȫ������ |
| B����ͼ��:��Ͳ�з����˼ӳɷ�Ӧ |
| C����ͼ��:������ɫ���� |
| D����ͼ��:ʪ�����ɫ��������ɫ,��������Һ�����ձ���,����Һ������,�����Cl2���� |
2011���й����������������Ⱥܴ�ͬʱҲ�����˿�����Ⱦ������β��װ��������ڴ�������������������õĹ�����ͼ��ʾ������˵����ȷ����
�� ��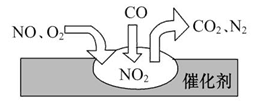
| A����Ӧ��NOΪ��������N2Ϊ�������� |
| B������β������Ҫ��Ⱦ�ɷְ���CO��NO��N2 |
| C��NO��O2�����ڴ���������ܷ�Ӧ |
D����ת���ܷ�ӦΪ2NO+O2+4CO 4CO2+N2 4CO2+N2 |