题目内容
(1)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol·L-1 Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20 mL Na2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为________.
(2)为测定m1 g粗氧化铜(其中含少量的氧化亚铁及不溶于酸的杂质)中氧化铜的质量分数,并制取无水硫酸铜,某实验的步骤如下:
a:加过量稀硫酸得到沉淀(m2g)和溶液.
b:加入氢氧化铜适量,调节溶液的PH=4得到沉淀为(m3g).
c:在溶液中加入一种氧化剂得到溶液.
d:溶液经过处理得到晶体.
e:晶体脱水得到固体(m4g)试回答下列问题:
1.以上步骤的正确顺序为________
2.氧化铜的质量分数计算表达式________
答案:

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
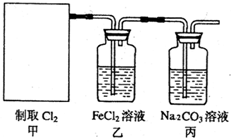 (2011?南京模拟)氯气是一种重要的化工原料.
(2011?南京模拟)氯气是一种重要的化工原料.