题目内容
漂白粉是一种常用的消毒剂.
(1)工业上生产漂白粉反应的化学方程式为: ,漂白粉的有效成分为 .
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究.根据下列试剂,设计实验方案,完成实验报告(在答题卡上作答).
限选试剂:2mol?L-1NaOH溶液、2mol?L-1HCl溶液、2mol?L-1HNO3溶液、0.5mol?L-1BaCl2溶液、0.01mol?L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水.
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00ml.则该漂白粉中Ca(ClO)2的质量分数为 .(只列算式,不做运算.已知:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
(1)工业上生产漂白粉反应的化学方程式为:
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究.根据下列试剂,设计实验方案,完成实验报告(在答题卡上作答).
限选试剂:2mol?L-1NaOH溶液、2mol?L-1HCl溶液、2mol?L-1HNO3溶液、0.5mol?L-1BaCl2溶液、0.01mol?L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水.
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液. | / |
| 步骤2:向沉淀加入适量2mol?L-1HCl溶液,将产生的气体通入 |
现象: 结论: |
| 步骤3:取滤液分装A、B两支试管.向A试管, |
现象:溶液先变红色,然后褪色. 结论: |
| 步骤4:向B试管, |
现象:产生白色沉淀. 结论: |
分析:(1)工业上生产漂白粉是利用强化过和氯气反应生成氯化钙、次氯酸钙和水;漂白粉的有效成分为次氯酸钙;
(2)取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液,向沉淀加入适量2mol?L-1HCl溶液,将产生的气体通入氢氧化钙溶液,依据生成沉淀现象检验碳酸钙的存在;取滤液分装A、B两支试管.向A试管滴加2滴酚酞试液,溶液先变红色,然后褪色该漂白粉含有Ca(ClO)2 ,可能含有Ca(OH)2,向B试管,滴加过量2mol?L-1HNO3溶液和0.01mol?L-1AgNO3溶液,依据氯离子反应生成白色沉淀的现象分析氯化钙的存在;
(3)依据化学方程式分析计算的关系为Ca(ClO)2~2Cl2~2I2~4Na2S2O3,注意反应过程中溶液体积的变化,根据定量关系计算得到;
(2)取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液,向沉淀加入适量2mol?L-1HCl溶液,将产生的气体通入氢氧化钙溶液,依据生成沉淀现象检验碳酸钙的存在;取滤液分装A、B两支试管.向A试管滴加2滴酚酞试液,溶液先变红色,然后褪色该漂白粉含有Ca(ClO)2 ,可能含有Ca(OH)2,向B试管,滴加过量2mol?L-1HNO3溶液和0.01mol?L-1AgNO3溶液,依据氯离子反应生成白色沉淀的现象分析氯化钙的存在;
(3)依据化学方程式分析计算的关系为Ca(ClO)2~2Cl2~2I2~4Na2S2O3,注意反应过程中溶液体积的变化,根据定量关系计算得到;
解答:解:(1)工业上生产漂白粉是利用强化过和氯气反应生成氯化钙、次氯酸钙和水,反应的化学方程式为,2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分为次氯酸钙;
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O; Ca(ClO)2;
(2)取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液,向沉淀加入适量2mol?L-1HCl溶液,将产生的气体通入氢氧化钙溶液,依据生成沉淀现象检验碳酸钙的存在;取滤液分装A、B两支试管.向A试管滴加2滴酚酞试液,溶液先变红色,然后褪色该漂白粉含有Ca(ClO)2 ,可能含有Ca(OH)2,向B试管,滴加过量2mol?L-1HNO3溶液和0.01mol?L-1AgNO3溶液,依据氯离子反应生成白色沉淀的现象分析氯化钙的存在;
故答案为:
(3)依据化学方程式中的定量关系分析,Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI,得到计算定量关系为:
Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=
n(Na2S2O3)=
×20.0 mL×10-3 L?mL-1×0.1 000mol?L-1×
,
Ca(ClO)2%=
×100%=
×100%,
故答案为:
×100%;
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O; Ca(ClO)2;
(2)取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液,向沉淀加入适量2mol?L-1HCl溶液,将产生的气体通入氢氧化钙溶液,依据生成沉淀现象检验碳酸钙的存在;取滤液分装A、B两支试管.向A试管滴加2滴酚酞试液,溶液先变红色,然后褪色该漂白粉含有Ca(ClO)2 ,可能含有Ca(OH)2,向B试管,滴加过量2mol?L-1HNO3溶液和0.01mol?L-1AgNO3溶液,依据氯离子反应生成白色沉淀的现象分析氯化钙的存在;
故答案为:
| 实验步骤 | 预期现象与结论 |
| 适量澄清石灰水 | 现象:沉淀溶解,产生的气体使石灰水变浑浊(产生沉淀),或石灰水先产生白色沉淀,后沉淀溶解 结论:该漂白粉含有CaCO3 |
| 滴加2滴酚酞试液 | 结论:该漂白粉含有Ca(ClO)2, 可能含有Ca(OH)2 |
| 滴加过量2mol?L-1HNO3溶液和0.01mol?L-1AgNO3溶液 | 结论:该漂白粉含有CaCl2 |
Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=
| 1 |
| 4 |
| 1 |
| 4 |
| 100ml |
| 25ml |
Ca(ClO)2%=
| ||||
| bg |
| 0.1000×20.00×143×100 |
| 4×1000×25.00b |
故答案为:
| 0.1000×20.00×143×100 |
| 4×1000×25.00b |
点评:本题考查了物质组成的实验分析判断,实验设计方法和反应现象的分析应用,滴定实验的有关定量分析计算,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 和
和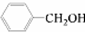 ,应选用
,应选用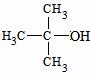
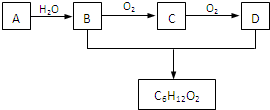

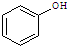 和
和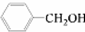 ,应选用______ (填字母).
,应选用______ (填字母).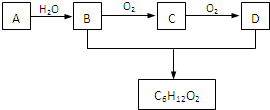
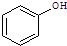 和
和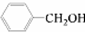 ,应选用______ (填字母).
,应选用______ (填字母).