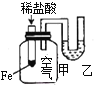
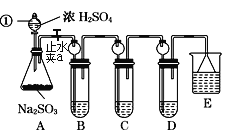
题目内容
【题目】实验室欲用固体NaOH配制100 mL 1 mol·L-1的NaOH溶液。
(1)用托盘天平称取NaOH固体的质量为____g
(2)下列情况使所配得溶液的浓度如何变化?(填“偏大”“ 偏小”或“不变”)
A.未洗涤溶解氢氧化钠的烧杯。____
B.容量瓶使用前用蒸馏水洗过,内壁附有水珠而未干燥处理。____
C.定容时加水超过了刻度线,将多出的液体吸出。____
D.定容时俯视容量瓶读数。____
【答案】4.0 偏小 不变 偏小 偏大
【解析】
(1)结合m=cVM计算,称量NaOH固体;
(2)根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
(1) 配制100 mL 1 mol·L-1的NaOH溶液需NaOH的质量,m=cVM=1mol/L![]() 0.1L
0.1L![]() 40g/mol=4.0g,故需称量NaOH固体4.0g;
40g/mol=4.0g,故需称量NaOH固体4.0g;
(2)A. 没有洗涤烧杯,会导致溶质的损失,则浓度偏小;
B. 若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,故所配浓度不变;
C.定容时加水超过了刻度线,溶液的体积偏大,且多出的液体吸出会导致容量瓶内溶质减少,故所配溶液的浓度偏小;
D. 定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
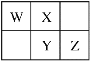
小学课堂作业系列答案【题目】下列实验现象不能充分说明相应的化学反应是放热反应的是
选项 | A | B | C | D |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |
A. A B. B C. C D. D
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
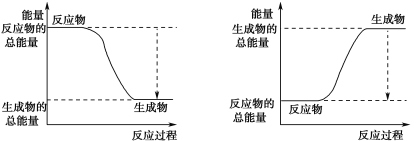
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止