题目内容
【题目】有下图所示装置:
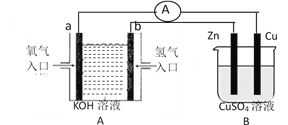
(1)装置A中b的电极名称为________极,a电极反应式为___________________________________;
(2)B装置中Cu为________极,电极反应式为___________________________________;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为______________ L。
【答案】 负 O2+2H2O+4e-=4OH- 阳 Cu-2 e-= Cu2+ 2.24
【解析】(1)装置A为原电池,b为负极,氢气失电子在碱溶液中生成水,电极反应为H2﹣2e﹣+2OH﹣=2H2O,a为正极,氧气得到电子生成氢氧根离子,电极反应为;O2+2H2O+4e﹣=4OH﹣;(2)B装置为电解池,铜电极做电解池的阳极,铜失电子生成铜离子,电极反应Cu﹣2e﹣=Cu2+;(3)当铜片的质量变化为12.8g时物质的量=![]() =0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为;O2+2H2O+4e﹣=4OH﹣,依据电子守恒得到,O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L。
=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为;O2+2H2O+4e﹣=4OH﹣,依据电子守恒得到,O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L。

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目