题目内容
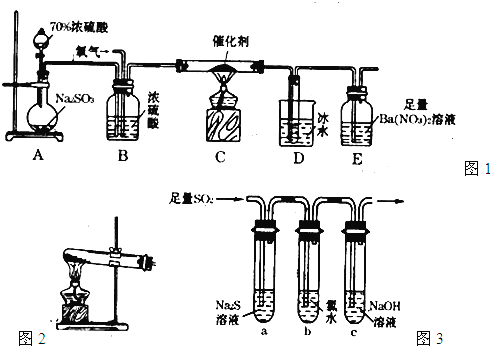
【题目】氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3molL-1min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 molL-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
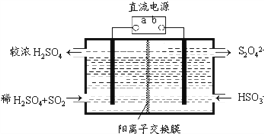
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。
(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 molL-1。将0.1 mol L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
【答案】 2ΔH1-ΔH2 K12/K2 75% > 50 SO2+2H2O-2e-=SO42-+4H+ 4S2O42-+6NO2+8OH-=8SO42-+3N2↑+4H2O 不能 此时溶液中c(Ba2+)<0.1 mol· L-1 ,c(SO32-)<6.3×10-8mol· L-1,c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7
【解析】(1)反应:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)、2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)、2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ),(Ⅰ)×2-(Ⅱ),则4NO2(g)+2NaCl(s)
2ClNO(g) K2 ΔH2<0 (Ⅱ),(Ⅰ)×2-(Ⅱ),则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =2ΔH1-ΔH2 (用ΔH1、ΔH2表示);平衡常数K= K12/K2 (用K1、K2表示)(2)测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则△n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为0.15mol/0.2mol×100%=75%;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;(3)常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol·L-1,NO2-的水解常数K=c(HNO2)×c(OH-)/c(NO2-)=2×10-11mol·L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为c(NO2-)/c(HNO2)=c(OH-)/2×10-11=50;(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为 4S2O42-+6NO2+8OH-=8SO42-+3N2↑+4H2O;(5)BaCl2溶液滴入饱和亚硫酸中,不能生成BaSO3沉淀,原因是此时溶液中c(Ba2+)<0.1 mol· L-1 ,c(SO32-)<6.3×10-8mol· L-1,浓度商Qc=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,所以不能产生沉淀。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =2ΔH1-ΔH2 (用ΔH1、ΔH2表示);平衡常数K= K12/K2 (用K1、K2表示)(2)测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则△n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为0.15mol/0.2mol×100%=75%;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;(3)常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol·L-1,NO2-的水解常数K=c(HNO2)×c(OH-)/c(NO2-)=2×10-11mol·L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为c(NO2-)/c(HNO2)=c(OH-)/2×10-11=50;(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为 4S2O42-+6NO2+8OH-=8SO42-+3N2↑+4H2O;(5)BaCl2溶液滴入饱和亚硫酸中,不能生成BaSO3沉淀,原因是此时溶液中c(Ba2+)<0.1 mol· L-1 ,c(SO32-)<6.3×10-8mol· L-1,浓度商Qc=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,所以不能产生沉淀。

【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:

有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是_____,装置A中发生反应的化学方程式为____________。
(2)B装置的作用除观察O2的流速之外。还有____________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是____________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_______(填标号),滴定終点的现象为_____________。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②C1元素的质量百分含量为(列出算式)____________。
③步骤III加入硝基苯的目的是___,如无此操作,所测C1元素含量将会___(填“偏大”“偏小”或“不变”)。
【题目】环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填"上"或"下"),分液后再用_________洗涤(填入编号)。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
A.KMnO4溶液 B.稀H2SO4 C. Na2CO3溶液