题目内容
4.下列说法错误的是( )| A. | 明矾可用于海水的净化,但不能用于海水的淡化 | |
| B. | 使用清洁能源是防止酸雨的重要的措施 | |
| C. | 胃酸过多的病人均可服用含Al(OH)3或NaHCO3的药物进行治疗 | |
| D. | 84消毒液可用来漂白某些衣物,为加快漂白速度,使用时可加入少量稀盐酸 |
分析 A.明矾水解生成氢氧化铝胶体,胶体具有吸附性而净水;但明矾不能吸附可溶性的物质;
B.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的;
C.含Al(OH)3或NaHCO3的药物能和盐酸反应生成盐,从而降低溶液酸性;
D.加入盐酸,发生氧化还原反应生成氯气,减小HClO的浓度.
解答 解:A.明矾水解生成氢氧化铝胶体,胶体能吸附水中悬浮物而净水;但明矾不能吸附可溶性的物质,所以不能进行海水淡化,故A正确;
B.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的,使用清洁能源减少了二氧化硫、氮氧化物的排放,所以能防止酸雨的形成,故B正确;
C.含Al(OH)3或NaHCO3的药物能和盐酸反应生成盐和水,从而降低溶液酸性,且二者碱性不强,故C正确;
D.加入盐酸,发生氧化还原反应生成氯气,减小HClO的浓度,则减弱84消毒液的漂白效果,故D错误;
故选D.
点评 本题考查物质的用途,明确物质的性质是解本题关键,性质决定用途,用途体现性质,易错选项是D,注意盐酸和次氯酸钠发生氧化还原反应生成氯气,学会利用化学知识解释生活现象,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
20.一定条件下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中进行,反应速率最快的是( )
| A. | v(NH3)=0.0020mol/(L•s) | B. | v(O2)=0.0026mol/(L•s) | ||
| C. | v(NO)=0.0020mol/(L•s) | D. | v(H2O)=0.0028mol/(L•s) |
15.下列有关物质性质的叙述正确的是( )
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | SO2具有氧化性,可用于漂白纸浆 | |
| C. | 氯化铝是一种电解质,可用于电解法制铝 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
12.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H +)=$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
9.下列说法正确的是( )
| A. | 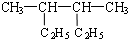 的名称是2,3-二甲基己烷 的名称是2,3-二甲基己烷 | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 有机物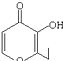 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 | |
| D. | 反应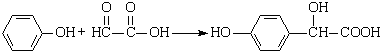 属于加成反应,理论上该反应的原子利用率为100% 属于加成反应,理论上该反应的原子利用率为100% |
13.下列有关物质用途的说法中错误的是( )
| A. | 自来水厂常用氯气给自来水消毒 | |
| B. | 澄清石灰可用于水鉴别Na2CO3和NaHCO3溶液 | |
| C. | 合金的机械性能一般比组分金属好,但有可能更加容易被腐蚀 | |
| D. | 加碘盐是在食盐中加入一定量的碘酸钾,以确保人体对碘的摄入量,可预防甲状腺肿大 |
14.下列关于化学观或化学研究方法的叙述中,错误的是( )
| A. | 为防止水体富营养化.必须控制富含氮、磷污水的排放 | |
| B. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| C. | 根据元索周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| D. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应产生的 |
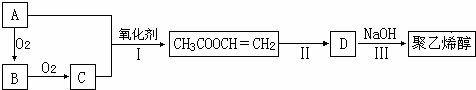
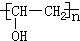 ;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;
;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;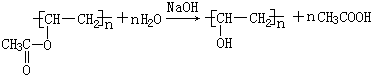 .
. ,Z由两个相同基团构成,该基团的名称是羟基.
,Z由两个相同基团构成,该基团的名称是羟基.