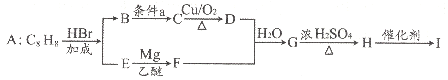
题目内容
【题目】Al、Cl、Cr、Ni等及其相关化合物用途非常广泛。回答下列问题:
(1)基态铬原子的价电子排布式为______。
(2)与硅原子未成对电子数相同的第四周期元素共有______种;钠与铝处于同周期,铝的熔沸点及硬度均比钠大,其原因是______。
(3)KAlO2在水溶液中实际上都是以K[Al(OH)4]形式存在。其中[Al(OH)4]-配离子,中心原子的杂化类型是____。该K[Al(OH)4]物质中存在的化学键有配位健、_____(填字母代号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.氢键
(4)CN2称为氰气,其性质与卤素单质相似。与氢氧化钠溶液反应产物之一为NaCN,写出两种与CN-互为等电子体的分子_____,N元素及与其同周期相邻的两种元素第一电离能由大到小的顺序为______。(填元素符号)
(5)氯化铯熔点:645℃,沸点:1290℃;氯化铝熔点:190℃,在180℃时开始升华,造成二者熔、沸点相差较大的原因是______;下图为氯化铯晶胞,已知氯离子半径为anm,铯离子半径为bnm,则氯化铯晶体密度为_____g·cm-3(用a、b和阿伏加德罗常数NA的代数式表式,列出算式即可)

【答案】3d54s1 4 铝原子半径较小且价电子较多,金属键更强 sp3 AB N2、CO N>O>C 二者晶体类型不同,氯化铯为离子晶体,熔沸点高;氯化铝为分子晶体,熔沸点低 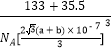
【解析】
(1)Cr是24号元素,其原子核外有24个电子,根据构造原理书写其原子核外电子排布式;
(2)硅原子的电子排布为:1s2 2s2 2p6 3s2 3p2,未成对电子数为2个,找出第四周期未成对电子数为2个的元素;比较金属单质的熔沸点可从金属键强弱进行比较,而金属原子半径越小,价电子越多,金属键越强,熔沸点越高;
(3)分析[Al(OH)4]-成键电子对数和孤电子对数可得到中心原子的杂化方式;K+与[Al(OH)4]-是离子键,配离子[Al(OH)4]-存在配位键,氧原子和氢原子之间是极性键;
(4)原子数和价电子数分别都相等的是等电子体,CN-的原子数为2,价电子总数为10,据此找出互为等电子体的分子;N元素电子排布为:1s2 2s2 2p3,2p能级为半充满状态,第一电离能比O还大;
(5)氯化铯熔点:645℃,沸点:1290℃,为离子晶体;氯化铝熔点:190℃,在180℃时开始升华,为分子晶体;铯离子和氯离子的堆积方式为体心立方堆积,那么晶胞体对角线就为(2a+2b)nm,则晶胞边长就为![]() nm,再根据均摊法进行分析计算密度;
nm,再根据均摊法进行分析计算密度;
(1)Cr是24号元素,原子核外电子排布式为1s22s22p63s23p63d54s1,价电子排布式为3d54s1;答案:3d54s1;
(2)硅原子的电子排布为:1s2 2s2 2p6 3s2 3p2,未成对电子数为2个,第四周期未成对电子数为2的元素有:Ti、Ni、Ge、Se;铝原子半径比钠原子小,价电子比钠原子多,金属键强,熔沸点高;答案:4;铝原子半径较小且价电子较多,金属键更强;
(3)[Al(OH)4]-的配位数为4,则 Al 原子的杂化形式是sp3 ;该K[Al(OH)4]物质中存在的化学键有极性键、配位和键离子键,选AB;答案:sp3;AB;
(4)CN-的原子数为2,价电子总数为10,与CN-互为等电子体的分子有N2和CO;N元素2p能级为半充满状态,第一电离能比O大,O第一电离能比C大,所以第一电离能N>O>C,
答案:N2、CO;N>O>C;
(5)氯化铯为离子晶体,氯化铝为分子晶体,晶体类型不同,离子晶体熔沸点比分子晶体高;铯离子位于四个顶点,晶胞占有8×1/8=1个,氯离子位于体心,所以晶胞占有1个;铯离子和氯离子的堆积方式为体心立方堆积,那么晶胞体对角线就为(2a+2b)nm,则晶胞边长就为![]() nm,那么晶胞密度为
nm,那么晶胞密度为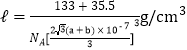 ;答案:二者晶体类型不同,氯化铯为离子晶体,熔沸点高;氯化铝为分子晶体,熔沸点低;
;答案:二者晶体类型不同,氯化铯为离子晶体,熔沸点高;氯化铝为分子晶体,熔沸点低;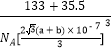 。
。

【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
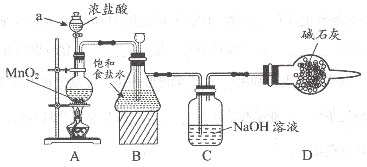
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为1l;2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HCO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_______,装置A中发生反应的离子方程式_____。
②C瓶溶液中的溶质是NaCl、______(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因_______。
(2)测定C瓶溶液中NaClO含量(单位:g)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为______。
②通常选用______作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_______g/L(保留2位小数)