��Ŀ����
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ��

��ش��������⣺
��1����ͼ��CԪ�ص�������Ϊ7����ԭ�ӷ���Ϊ_____��Ԫ��I��Gͬ����,λ�ڵ���������Ԫ��I��ԭ�ӽṹʾ��ͼ______��
��2��F��G��HԪ����̬�⻯����ȶ�����ǿ������˳��Ϊ_______________���û�ѧʽ��ʾ��
��3��������X��BԪ�ص��������������ʽΪ_________����ͼ��CԪ�ص�һ���⻯��Y��10������, Y��O2�����û���Ӧ�Ļ�ѧ����ʽΪ_________��
��4��H������������Ӧ��ˮ�����Ũ��Һ���ȶ������ȿɷֽ⣬����֮һ��H�ĵ��ʣ��ҵ���28mol����ת��ʱ���ָ������¹�����9mol���壬д���÷�Ӧ�Ļ�ѧ����ʽ__________��
��5��������Ԫ���еļ������a��b��c��d�����ʣ�ijͬѧ���ʵ������ͼװ��֤��Ԫ��B��C��F�ķǽ�����ǿ����������Һb����Һc��Ϊ��������
����Һa��b�ֱ�Ϊ_____��___���ѧʽ����
����Һc�е����ӷ���ʽΪ_________��
�����ԭ�ӽṹ�ĽǶȽ��ͷǽ�����C��B��ԭ��_________��
���𰸡�![]()
 HCl��H2S��SiH4
HCl��H2S��SiH4 ![]() 4NH3+3O2
4NH3+3O2![]() 2N2+6H2O 4HClO4�T2Cl2��+7O2��+2H2O HNO3 NaHCO3
2N2+6H2O 4HClO4�T2Cl2��+7O2��+2H2O HNO3 NaHCO3 ![]() +CO2+H2O=H2SiO3��+
+CO2+H2O=H2SiO3��+![]() ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ��
̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ��
��������
��ͼ�л��ϼۿ�֪��D�Ļ��ϼ�ֻ��-2�ۣ�û�������ϼۣ���DΪOԪ�أ�A��+1��-1�ۣ���ԭ��������С��AΪHԪ�أ�B��ԭ������С��O ��B�Ļ��ϼ�Ϊ+4��-4�ۣ�BΪCԪ�أ�C��ԭ������С��O��C�Ļ��ϼ���+5��-3�ۣ���CΪNԪ�أ�E��ԭ����������O����E�Ļ��ϼ�Ϊ+1�ۣ����ڢ�A�壬��EΪNaԪ�أ�F��B�Ļ��ϼ���ͬ��F��Bλ��ͬ���壬F��ԭ����������FΪSi��G���������Ϊ+6�ۡ���ͼ�Ϊ-2��ӦΪSԪ�أ�H���������Ϊ+7��ԭ�����������HΪCl���Դ������
������������֪��AΪHԪ�أ�BΪCԪ�أ�CΪNԪ�أ�DΪOԪ�أ�EΪNaԪ�أ�FΪSiԪ�أ�GΪSԪ�أ�HΪClԪ�أ�
��1��CΪNԪ�أ��˵����Ϊ7��������Ϊ7��NԪ�ص�������Ϊ7����������Ϊ7+7=14����ԭ�ӷ���Ϊ![]() ��GΪSԪ�أ�λ�ڵ�������VIA�壬Ԫ��I��Gͬ���壬λ�ڵ������ڣ���IΪSeԪ�أ��˵����34������34�����ӣ�K��L��M��N�����������Ϊ2��8��18��6����ԭ�ӽṹʾ��ͼΪ
��GΪSԪ�أ�λ�ڵ�������VIA�壬Ԫ��I��Gͬ���壬λ�ڵ������ڣ���IΪSeԪ�أ��˵����34������34�����ӣ�K��L��M��N�����������Ϊ2��8��18��6����ԭ�ӽṹʾ��ͼΪ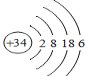 ����Ϊ
����Ϊ![]() ��
�� ��
��
��2��FΪSiԪ�أ�GΪSԪ�أ�HΪClԪ�أ�����ͬ����Ԫ�أ������ң�Ԫ�صķǽ�����������ǿ����ǽ�����Si��S��Cl���ǽ���Խǿ������̬�⻯��Խ�ȶ�������̬�⻯����ȶ�����ǿ������˳��ΪHCl��H2S��SiH4����ΪHCl��H2S��SiH4��
��3��BΪCԪ�أ�������X��BԪ�ص���������X��CO2��CO2��Cԭ����ÿ��Oԭ���γ����Թ��õ��Ӷԣ������ʽΪ![]() ��CΪNԪ�أ���һ���⻯��Y��10������ΪNH3��NH3��O2�����û���Ӧ�Ļ�ѧ����ʽΪ4NH3+3O2
��CΪNԪ�أ���һ���⻯��Y��10������ΪNH3��NH3��O2�����û���Ӧ�Ļ�ѧ����ʽΪ4NH3+3O2![]() 2N2+6H2O����Ϊ
2N2+6H2O����Ϊ![]() ��4NH3+3O2
��4NH3+3O2![]() 2N2+6H2O��
2N2+6H2O��
��4��HΪClԪ�أ�Cl������������Ӧ��ˮ�����Ũ��Һ���ȶ������ȿɷֽ⣬����֮һ���ȵĵ��ʣ��ҵ���28mol����ת��ʱ�����¹�����9mol���壬�ȵĵ���Ϊ������ClԪ����+7�۵õ��ӱ�Ϊ0�ۣ�����2mol����ʱ���ɵõ�28mol���ӣ����ɵ����غ��֪������7mol�������÷�ӦΪ4HClO4�T2Cl2��+7O2��+2H2O����Ϊ4HClO4�T2Cl2��+7O2��+2H2O��
��5��BΪCԪ�أ�CΪNԪ�أ�FΪSiԪ�أ�����ͼװ��֤��Ԫ��C��N��Si�ķǽ�����ǿ������ͼ��֪����ƿ�з���������̼��Ƶķ�Ӧ���ɶ�����̼����Һb�ɳ�ȥ������̼�лӷ������ᣬ�Լ�Ϊ����̼�����ƣ���ҺcΪ�����ƣ�������ǿ����ȡ����ķ�Ӧ��
����Һa��b�ֱ�ΪHNO3������NaHCO3����ΪHNO3��NaHCO3��
����Һc�е����ӷ���ʽΪ![]() +CO2+H2O=H2SiO3��+
+CO2+H2O=H2SiO3��+![]() ������SiO32-+CO2+H2O=H2SiO3��+
������SiO32-+CO2+H2O=H2SiO3��+![]() ��
��
�۴�ԭ�ӽṹ�ĽǶȽ��ͷǽ�����N��C��ԭ����Ϊ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ����Ϊ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��800��ʱ����2L�����ܱ�������Ͷ��0.20molNO��0.12mol O2�������з�Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��n(NO)��ʱ��ı仯������±���
2NO2(g)��n(NO)��ʱ��ı仯������±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.04 | 0.04 |
��1��800��ʱ���÷�Ӧƽ��ʱ��NO�����ʵ���Ũ��Ϊ______�������¶ȣ�NO��ƽ��Ũ��Ϊ0.03molL-1����÷�ӦΪ_______��Ӧ(��������������������)��
��2����O2��ʾ0��2s�ڸ÷�Ӧ��ƽ����Ӧ����v(O2)��______��
��3����˵���÷�Ӧһ���ﵽƽ��״̬����______��
a v(NO2)��2v(O2)���� b ������ѹǿ���ֲ���
c ������������ɫ���ֲ��� d �����������ܶȱ��ֲ���
��4�� ƽ������д�ʩ��ʹ�÷�Ӧ������Ӧ�����ƶ���������Ӧ�����������____��
a �ʵ������¶� b �ʵ������¶�
c ����O2��Ũ�� d ѡ���Ч����
��5��800��ʱ��������Ӧ��ƽ�ⳣ��K��______���������к�1.00 molL-1 NO��2.00 molL-1O2��2.00 molL-1 NO2�����ʱv��_______v�� (������������������������)��
����Ŀ��ij����С���ͬѧ��ʵ����������װ����ȡ��������������Ҫ�������£�
����30mL�Ĵ��Թ�A�а������2��3��2�ı�������Ũ���ᡢ�Ҵ�������Ļ����Һ��
�ڰ���ͼ���Ӻ�װ�ã�װ�����������ã�����С����ȵؼ���װ�л����Һ�Ĵ��Թ�5~10min��
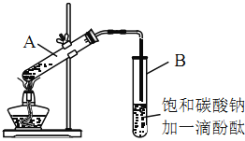
�۴��Թ�B�ռ���һ���������ֹͣ���ȣ������Թ�B��������Ȼ���ô��ֲ㡣
�ܷ�������������㡢ϴ�ӡ����
��֪�������ݣ�
���� | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g/cm3�� |
�Ҵ� | ��117.0 | 78.0 | 0.79 |
���� | 16.6 | 117.9 | 1.05 |
�������� | ��83.6 | 77.5 | 0.90 |
Ũ���ᣨ98%�� | �D�D | 338.0 | 1.84 |
��ش��������⣺
��1�����Ƹû����Һʱ���������������ʵ��Ⱥ�˳����___________��д����ȡ���������Ļ�ѧ����ʽ��___________��
��2����ʵ���У�Ũ�����������___________��
��3������ʵ���б���̼������Һ��������___________������ĸ����
A ���ղ����Ҵ�
B �����
C ���������������ܽ�ȣ������ڷֲ�����
D �����������ɣ���������
��4�����������ҪС����ȼ��Ȳ���������Ҫ������___________��
��5���������B�Թ��ڵ��ϲ�������___________�����������ƣ���
��6��������з�������õ�����Ҫ������___________����ѡ�õĸ����Ϊ___________������ĸ����
A ��ʯ�� B NaOH����
C ��ʯ�� D ��ˮNa2SO4