题目内容
工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | | | |
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是__________(填序号)。
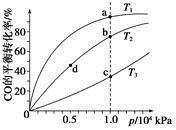
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
(1)吸热 (2)K1·K2 (3)> (4)CD
解析

练习册系列答案
相关题目
(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2变化曲线的是__________,用O2表示从0 s~2 s 内该反应的平均速率v=________。
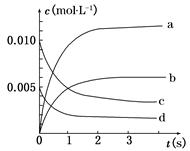
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)??2CO2(g)+N2(g) ΔH<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验 编号 | T(℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂的比表 面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | 1.2×10-3 | | 124 |
| Ⅲ | 350 | | | 82 |
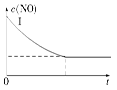
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100 mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和________;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:_______________________________________________________________。
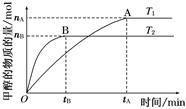
 pC(气) + qD(气)的 C %与时间 t有如图关系
pC(气) + qD(气)的 C %与时间 t有如图关系
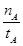 mol·L-1·min-1
mol·L-1·min-1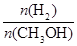 增大
增大 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。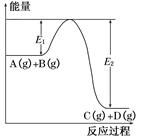
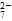 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。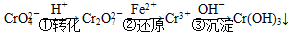
 Cr2O
Cr2O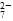 和CrO
和CrO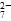 )=v(CrO
)=v(CrO